Hypothèse du monde à ARN
L'hypothèse du monde à ARN (en anglais : RNA world) est une hypothèse selon laquelle l'acide ribonucléique serait le précurseur de toutes les macromolécules biologiques et particulièrement de l'ADN et des protéines. Cette hypothèse permet une explication de l'apparition des différentes fonctions biologiques dans le cadre de l'étude des origines de la vie.
L'hypothèse du monde à acide ribonucléique (ARN) est que l'ARN était la principale — et sans doute la seule — forme de vie avant l'émergence de la première cellule à ADN. C'est le biochimiste américain Walter Gilbert, prix Nobel de chimie en 1980, qui a utilisé pour la première fois le terme RNA world en 1986.
L'hypothèse d'un monde à ARN, qui a depuis la fin des années 2010 la faveur des scientifiques, est fondée sur plusieurs éléments, et surtout sur la découverte que l'ARN est capable aussi bien d'être le support d'une information génétique que d'assurer des tâches métaboliques, comme le montre l'activité enzymatique de l'ARN ribosomique, et d'une manière générale l'existence de ribozymes.
Historique[modifier | modifier le code]
Le paradoxe de l'origine[modifier | modifier le code]

L'ADN est aujourd'hui le support de nos gènes, et contient les instructions de production des protéines. La réplication de l'ADN est assurée par des protéines, les ADN polymérases[1]. L'ADN, formant une double hélice rigide, ne peut se replier pour jouer un rôle de catalyseur. Les protéines impliquées dans le métabolisme (les enzymes) possèdent la propriété de catalyseurs, mais sont incapables de stocker l'information requise pour leur propre synthèse, c'est-à-dire leur autoréplication.
La difficulté vient de ce que ce ne sont pas les mêmes polymères qui portent l'information génétique (ADN) et les fonctions catalytiques nécessaires à la réplication (protéines). Ces deux sortes de polymères étant très complexes et chimiquement très différents, il était difficile d'imaginer comment ils avaient pu apparaître simultanément et indépendamment. Il en résulte un paradoxe de l'œuf et de la poule si on se pose la question de savoir qui des protéines ou de l'ADN est apparu le premier au cours de l'émergence de la vie telle que nous la connaissons aujourd'hui.
Acide ribonucléique (ARN)[modifier | modifier le code]
Dans la biochimie actuelle, l'acide ribonucléique (ARN) joue un double rôle d'intermédiaire entre l'ADN support d'information et les polypeptides catalyseurs : l'ARN polymérase guide la polymérisation d'un brin ARN messager en suivant la composition d'une séquence de l'ADN, puis un ribosome guide la polymérisation d'un polypeptide en suivant la composition de cet ARN messager. Cette seconde traduction s'appuie sur une famille d'ARN de transfert, qui apportent l'acide aminé compatible avec la séquence de l'ARN messager en cours de traitement. En amont de la formation des protéines, les cellules vivantes contiennent une vingtaine de familles d'ARN de transfert, chacune d'elles étant spécifique de l'un des acides aminés ; le ribosome assurant le décodage d'un ARN en assemblant les acides aminés dans l'ordre spécifié par l'ARN messager.
L'ARN est un polymère linéaire constitué d'un enchaînement de nucléotides. On trouve quatre bases nucléiques dans l'ARN : l'adénine, la guanine, la cytosine et l'uracile. L'ARN a de nombreuses similitudes avec l'ADN, avec cependant quelques différences importantes : d'un point de vue structurel, l'ARN est chimiquement moins stable ; sur le plan fonctionnel, l'ARN se trouve le plus souvent dans les cellules sous forme monocaténaire, c'est-à-dire de simple brin ; enfin, les molécules d'ARN présentes dans les cellules sont plus courtes, leur taille variant de quelques dizaines à quelques milliers de nucléotides. La plupart des ARN naturels sont présents sous forme monocaténaire (simple brin) dans la cellule[2].
De même que les protéines, les brins d'ARN se replient le plus souvent sur eux-mêmes, formant une structure intramoléculaire qui peut être très stable et très compacte. La description des appariements internes entre les bases d'un ARN s'appelle la structure secondaire. La base de cette structure est la formation d'appariements internes, entre bases complémentaires : A avec U, G avec C (et, parfois, G avec U).
Découverte de l'ARN catalytique[modifier | modifier le code]

Dans les années 1980, Tom Cech et Sidney Altman ont découvert indépendamment que certains ARN, ensuite appelés ribozymes, pouvaient avoir un rôle de catalyseur, comme les protéines. Cette découverte inattendue a valu à Cech et Altman le prix Nobel de chimie en 1989.
En 1990, Larry Gold et Jack Szostak ont mis au point une méthode visant à diriger l'évolution d'ARN, afin de sélectionner ceux montrant une activité catalytique. Ils ont depuis réussi à obtenir des ribozymes capables de lier des nucléotides entre eux, de lier des acides aminés à des ARN, d'effectuer des réactions d'oxydo-réductions, de se lier à des composants de la membrane, etc.
L'ARN a la capacité de stocker une information, en utilisant un code génétique similaire à celui de l'ADN. L'ARN peut également se comporter comme un ribozyme (contraction de ribose et enzyme) et catalyser certaines réactions, tout comme les enzymes. Du point de vue de la reproduction, cette molécule possède donc deux fonctions primordiales : le stockage de l'information et la catalyse nécessaire à l'autoréplication.
Ainsi, le ribosome est un ribozyme, dans le sens où le responsable de la synthèse des protéines n'est pas une protéine (comme c'est le cas dans la grande majorité des catalyses d'une cellule vivante) mais l'ARN ribosomique lui-même. Ces ribozymes peuvent se replier dans l'espace, faisant apparaître un site actif pour une catalyse, à l'instar des protéines.
Hypothèse d'un monde à ARN[modifier | modifier le code]
L'hypothèse d'un monde à ARN, qui a aujourd'hui la faveur des scientifiques[3],[4], est fondée sur cette découverte. Thomas Cech indiqua que l'ARN pouvait être la première molécule répliquante du fait de ses propriétés catalytiques et auto-catalytiques :
- la structure des ARN est à la base de la richesse de leurs fonctions, et en particulier de leur capacité à catalyser des réactions chimiques (ribozymes) ;
- inversement, les règles d'appariement relativement rigides entre les bases de l'ARN permettent de transcrire un brin en son négatif, et par une nouvelle transcription permettent de dupliquer l'original.
Du point de vue de la reproduction, cette molécule possède donc deux fonctions primordiales : le stockage de l'information et la catalyse nécessaire à l'autoréplication. Il est donc en théorie possible, sur ce modèle, que l'ARN seul suffise à établir un métabolisme primitif. Les ribozymes étant capables d'assurer à la fois le rôle de support de l'information génétique et de catalyseur, cela permettait de s'affranchir du paradoxe, en proposant que l'ARN soit le précurseur unique, ce qui a été proposé en 1986 par Walter Gilbert, le co-inventeur du séquençage de l'ADN. Toutefois l'idée d'une vie à base d'ARN est plus ancienne et remonte à Carl Woese dans The Genetic Code[5].
Les ARN sont présents dans les trois lignées du monde vivant (archées, procaryotes, eucaryotes). Ils accomplissent dans chacun un grand nombre de tâches différentes, les plus connus sont l'ARN messager (ARNm, véhiculant l'information génétique de l'ADN vers les ribosomes), l'ARN de transfert (ARNt, faisant le lien entre acide nucléique et acide aminé) et l'ARN ribosomique (ARNr, composant structuraux et fonctionnels des ribosomes). À côté de ceux-ci, on peut trouver un grand nombre d'ARN impliqués dans des fonctions tels que des catalyses, des régulations de l'expression de gènes, des contrôles, des défenses antivirales, des extinctions de gènes, des inhibitions de synthèses de protéines, des restaurations génomiques, etc. C'est le cas des ARN interférents, dont certains chercheurs qualifient le mécanisme d'« universel ». Les ARNtm des procaryotes ont également plusieurs fonctions : ils jouent à la fois les rôles d'ARN de transfert et d'ARN messager.
Interprétation du caractère « autorépliquant »[modifier | modifier le code]
L'image se dégageant de ces études est celle d'une population de brins d'ARN en interdépendance mutuelle, se reproduisant au sein d'une sorte d'écosystème chimique, et où chaque brin est en compétition sélective par rapport à ses propres allèles. C'est par exemple sa capacité optimale à se dupliquer rapidement dans un environnement peuplé d’enzymes ARN polymérase ARN-dépendante et de bases d'ADN, y compris sans amorce d'ARN initiale[6], qui caractérise le monstre de Spiegelman (en) : cette chaîne de 218 nucléotides d'ARN est un parasite prospérant dans un milieu contenant l'ARN polymérase et les bases d'ARN.
En toute rigueur il est abusif de parler d'« autoréplication », puisqu'un brin d'ARN ayant la capacité de catalyser une réplication (ARN polymérase ARN-dépendante) ne le fait pas sur le brin catalyseur lui-même, mais au mieux sur une réplique de ce brin. Le brin polymérase agent de la réplication est distinct du brin objet de cette même réplication : même quand ces deux brins sont similaires ils ne sont pas confondus. De plus, cette « réplication » consiste dans la totalité des modèles à produire le brin complémentaire d'un brin donné, pas directement un brin identique. Ce n'est que dans un deuxième temps, lorsque le brin complémentaire est lui-même répliqué, qu'un brin identique à la polymérase est effectivement synthétisé.
Aucun des modèles proposés ne suppose que la polymérase (en tant qu'agent) réplique préférentiellement (comme cible) des brins identiques à elle-même[7] La présence de la polymérase conduit à répliquer tous les brins présents dans la solution. Dans ces conditions, l'avantage sélectif d'un allèle ne consiste pas en tant qu'agent à dupliquer plus ou moins rapidement d'autres brins (puisque tous vont en profiter), mais bien en tant que cible à être dupliqué plus rapidement tout en conservant ses capacités de duplication.
Arguments soutenant cette hypothèse[modifier | modifier le code]
Antériorité dans le métabolisme[modifier | modifier le code]
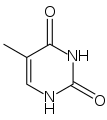
Du point de vue de la biologie cellulaire, l'ADN est produit par modification d'un ARN : les désoxyribonucléotides (précurseurs de l'ADN) sont en effet produits à partir des ribonucléotides (précurseurs des ARN). De plus, le groupement thymine (identifié comme T dans le code génétique), est construit à partir d'un groupement uracile (U). Or, bien que l'uracile soit spécifique à l'ARN et la thymine à l'ADN, le groupement U est, au moment de la synthèse, déjà fixé sur un désoxyribonucléotide.
-
Uracile
-
Thymine
La synthèse des désoxyribonucléotides de l'ADN (dA, dC, dT, dG) passe par celle des bases de l'ARN (A, C, U, G), puis une réduction (donnant dA, dC, dG et dU) et une modification supplémentaires pour synthétiser dT à partir de ce dU. Cette voie indirecte serait la trace du passage d'un monde à ARN à un monde à ADN.
Synthèse prébiotique[modifier | modifier le code]
En 1961, Joan Oró démontre que de l'adénine, la base purique des acides nucléiques, se forme en chauffant des solutions aqueuses de cyanure d'ammonium (en)[8].
En 2007 on montre, à l'appui d'une abiogenèse dans l'eutectique eau-glace, que des s-triazines (des nucléobases alternatives), des pyrimidines (dont la cytosine et l'uracile) et de l'adénine se forment dans des solutions d'urée soumises à des cycles gel/dégel sous atmosphère réductrice (avec des décharges d'étincelles comme source d'énergie)[9].
En 2022, la capacité des verres volcaniques de composition basaltique à catalyser la polymérisation des acides nucléiques est démontrée expérimentalement : les nucléotides s'assemblent spontanément en chaînes d'ARN, qui grandissent jusqu'à comporter quelques centaines de « lettres » au bout de quelques mois. La formation des nucléosides elle-même est catalysée par ces verres[10],[11].
Le cas de l'ARN de transfert[modifier | modifier le code]

Le rôle de l'ARNt est de transporter un acide aminé vers le ribosome, où s'effectuera la liaison avec un autre acide aminé, pour former un polypeptide (donnant ainsi une protéine). Il existe plusieurs ARNt, possédant chacun trois nucléotides : l'anticodon. L'anticodon est complémentaire d'un codon, porté par l'ARNm qui définit l'ordre d'assemblage des acides aminés par le ribosome.
La particularité de l'ARNt est qu'il est, malgré sa petite taille, en partie constitué de nombreux nucléotides que l'on ne rencontre pas ailleurs. Ces nucléotides « exotiques » auraient ainsi une origine prébiotique, vestiges d'un monde à ARN. On retrouve ainsi ces composants dans l'ensemble des trois domaines du vivant.
Virus et ARNt[modifier | modifier le code]
Il est relativement fréquent d'observer des virus à ARN ou des viroïdes portant des motifs similaires à de l'ARNt. Ainsi, dans le viroïde PSTV (Potato Spindle Tuber Viroïd) et l'ARNt de la tyrosine, on trouve les mêmes motifs structuraux en « feuille de trèfle ». Pour Marie-Christine Maurel, « ces derniers jouent un rôle fondamental dans le vivant et leur ancienneté ne fait pas de doute ».
Autre structure surprenante : chez le virus TYMV (Turnip Yellow Mosaic Virus), l'amorce de la traduction du génome du virus en protéine se fait par le biais d'une structure de type ARNt qui amorce sa propre traduction et qui fixe un acide aminé.
ARN et hérédité[modifier | modifier le code]
L'ARN joue un rôle dans la transmission de l'activité des gènes : un tel mécanisme (qualifié d'épigénétique) n'est pas lié à l'ADN, et serait une preuve de la capacité de l'ARN à participer à l'hérédité.
Passage de l'ARN à l'ADN[modifier | modifier le code]
Hypothèse de l'origine virale[modifier | modifier le code]
Par rapport à l'ARN, l'ADN est plus stable du fait de la désoxygénation du ribose ; et une désamination (génératrices de mutations) de la cytosine la transformant en uracile peut être détectée et réparée, U n'étant pas normalement présent dans l'ADN. De ce fait, utiliser l'ADN comme support de l'information génétique a permis de diminuer les erreurs de duplication des gènes, donc d'augmenter leur longueur, et partant, la complexité du métabolisme associé[12].
Ce n'est cependant pas cette capacité à autoriser des métabolismes complexes qui a pu constituer un avantage sélectif pour cette transition, puisque la transition initiale demande la mise en place des voies métaboliques associées à l'ADN, ce qui au départ entraîne un coût qui n'est pas immédiatement compensé par l'avantage que peut procurer un métabolisme plus complexe.
Certains scientifiques (comme le virologiste Patrick Forterre de l'Institut de Génétique et Microbiologie, à Orsay) pensent que ce sont les virus qui seraient les "inventeurs" de l'ADN[12].
L'apparition de l'ADN viral dans un monde à ARN serait une solution pour déjouer les défenses cellulaires. On sait en effet que certains virus modernes altèrent leur ADN pour le rendre résistant aux enzymes nucléases de leur hôte (par méthylation, hydroxyméthilation, ou autre)[12]. On peut imaginer qu'une forme de camouflage pour un virus à ARN a été, de même, de simplement désoxygéner le ribose, créant un ADN ancestral formé avec de l'uracile[12]. Dans une seconde étape, ces virus auraient remplacé le groupement uracile par un groupement thymine, suivant la même synthèse que pour l'ADN moderne.
Dans un tel scénario, les virus initialement à ARN auraient acquis un double système de traduction : un premier système de réduction des ARN en ADN de type ribonucléotide réductase, et un système de transcription inverse[13].
Transmission aux microbes[modifier | modifier le code]
[14] Il semble par ailleurs y avoir peu d'homologies entre les enzymes essentielles à la réplication, la réparation et la recombinaison de l'ADN chez les eubactéries, les archées et les eucaryotes : leur ancêtre commun aurait donc été dépourvu d'un certain nombre de ces enzymes (inutiles en l'absence de génome ADN). Ces protéines seraient alors apparues indépendamment dans chaque grande lignée (peut-être à partir de gènes viraux dans certains cas).
Une grande distribution phylogénétique[modifier | modifier le code]
Malgré leur grande diversité structurelle et fonctionnelle, la répartition des ARN permet de retrouver le découpage du vivant. Ainsi, les petits ARN nucléolaires ne sont partagés que par les archées et les eucaryotes, l'ARN de la télomérase n'est lui présent que chez les eucaryotes alors que les procaryotes sont les seules à posséder des ARNtm. De la même façon, les trois grands types d'ARN (ARNt, ARNm et ARNr) sont présents dans les trois lignées.
Efficacité des protéines[modifier | modifier le code]

Les protéines sont des catalyseurs très efficaces, bien plus que les ribozymes. De même, il existe 20 acides aminés dans le monde vivant, mais seulement quatre nucléotides, les protéines sont donc bien plus diversifiées que les ARN.
D'un point de vue évolutif, il est donc peu probable qu'une protéine-enzyme ait été remplacée par une ARN-enzyme. À l'inverse, si les ARN sont bien apparus avant les protéines, il est plausible qu'ils aient été remplacés par des protéines, plus efficaces.
Cet argument est étayé par le fait que l'ARN joue un rôle dans la synthèse des protéines, via son rôle fondamental dans les ribosomes actuels. L'ARN aurait donc en quelque sorte conduit à l'apparition des protéines.
Les protéines utilisées dans la structure du ribosome seraient donc venues plus tard : les premières protéines auraient été sélectionnées selon leur capacité d'amélioration du fonctionnement des ribozymes, pour finalement se substituer à eux.
Difficultés[modifier | modifier le code]
Des phénomènes aussi fondamentaux et anciens sont très difficiles à étayer, la longue évolution ayant effacé en grande partie leurs éventuelles traces.
L'ARN est une molécule complexe et très instable (bien plus que la double hélice d'ADN) : il est susceptible d'être hydrolysé du fait de la présence du groupe hydroxyle sur un carbone du ribose (autodestruction intramoléculaire, notamment à haute température et pH élevé) et de son organisation monobrin. Pour que l'hypothèse du monde à ARN soit crédible, il faut imaginer qu'un précurseur ARN suffisamment long, capable de se répliquer ait pu émerger spontanément dans la soupe prébiotique. Cet événement semble très improbable à un certain nombre de scientifiques. Pour contourner cette difficulté, il a été proposé qu'un précurseur plus simple que l'ARN ait précédé celui-ci[15],[16].
Il a été également émis comme hypothèse l’émergence et le développement de la vie dans des milieux glacés, l’ARN se développant plus facilement dans la glace que dans des températures élevées (les nucléotides s’assemblent naturellement pour former des brins d’ARN lorsqu’ils sont dans un environnement gelé)[17].
Les succès en synthèse prébiotique d'ARN par l'équipe de John Sutherland (en) en 2009 montrent cependant que l'apparition spontanée d'ARN dans la « soupe prébiotique » n'est pas aussi improbable qu'on ne l'avait cru initialement. En 2019, un mécanisme est découvert qui permet la synthèse prébiotique des nucléosides de l'ARN des deux familles, purine comme pyrimidine, dans un même environnement et par une simple succession d'épisodes secs et humides[3],[4].
Ces expériences ne lèvent cependant pas les incertitudes « sur l'origine prébiotique du ribose et sur la stabilité de l'ARN en solution, car tous les deux sont très labiles. C'est la raison pour laquelle la recherche d'autres polymères analogues d'acides nucléiques qui auraient pu agir comme précurseurs de ces derniers dans d'éventuels « mondes pré-ARN » est très active » : l'acide nucléique à glycol, l'acide nucléique à thréose, l'acide nucléique peptidique ou l'acide nucléique bloqué peuvent éventuellement transférer l'information génétique vers l'ARN mais ils n'existent pas dans la nature[18].
Notes et références[modifier | modifier le code]
- (en) Biology 6th edition, Raven & Johnson, p. 290
- Harvey Lodish, Arnold Berk, Paul Matsudaira, Chris-A Kaiser, M. Krieger, M.P. Scott, Lodish Zipursky et James Darnell, Biologie moléculaire de la cellule, Bruxelles, de Boeck, , 3e éd., 1096 p. (ISBN 978-2-8041-4802-7).
- (en) Nicholas V. Hud et David M. Fialho, « RNA nucleosides built in one prebiotic pot », Science, vol. 366, no 6461, , p. 32-33 (DOI 10.1126/science.aaz1130).
- (en) Sidney Becker, Jonas Feldmann, Stefan Wiedemann, Hidenori Okamura, Christina Schneider et al., « Unified prebiotically plausible synthesis of pyrimidine and purine RNA ribonucleotides », Science, vol. 366, no 6461, , p. 76-82 (DOI 10.1126/science.aax2747).
- (en) Carl Woese, The Genetic Code, Harper & Row, 1968 (ISBN 978-0-06-047176-7)
- M Sumper et R. Luce, « Evidence for de novo production of self-replicating and environmentally adapted RNA structures by bacteriophage Qbeta replicase », Proceedings of the National Academy of Sciences, vol. 72, no 1, , p. 162–166 (PMID 1054493, PMCID 432262, DOI 10.1073/pnas.72.1.162).
- The RNA World: molecular cooperation at the origins of life. Higgs, P., Lehman, N. Nat Rev Genet 16, 7–17 (2015). https://doi.org/10.1038/nrg3841.
- (en) J. Oró, « Mechanism of synthesis of adenine from hydrogen cyanide under possible primitive Earth conditions », Nature, vol. 191, no 4794, , p. 1193-1194 (DOI 10.1038/1911193a0).
- (en) « Synthesis of pyrimidines and triazines in ice: implications for the prebiotic chemistry of nucleobases », Chemistry: A European Journal, vol. 15, no 17, , p. 4411-4418 (DOI 10.1002/chem.200802656).
- (en) Robert F. Service, « Did volcanic ‘glasses’ help spark early life? », Science, (DOI 10.1126/science.add3257, lire en ligne
 , consulté le ).
, consulté le ).
- (en) Craig A. Jerome, Hyo-Joong Kim, Stephen J. Mojzsis, Steven A. Benner et Elisa Biondi, « Catalytic Synthesis of Polyribonucleic Acid on Prebiotic Rock Glasses », Astrobiology (en), (DOI 10.1089/ast.2022.0027, lire en ligne
 , consulté le ).
, consulté le ).
- The origin of viruses and their possible roles in major evolutionary transitions. Patrick Forterre, Virus Research 117 (2006) 5–16.
- HAL Id: hal-00023464 Virus evolution : the emergence of new ideas (andre-emergence of old ones). Jean-Michel Claverie. hal-00023464.
- Viruses and cells intertwined since the dawn of evolution. Durzyńska, J., Goździcka-Józefiak. Virol J 12, 169 (2015).
- (en) Gerald F. Joyce, « RNA evolution and the origins of life », Nature, vol. 338, no 6212, , p. 217–224 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/338217a0, lire en ligne, consulté le )
- (en) Keiji Murayama, Hikari Okita, Takumi Kuriki et Hiroyuki Asanuma, « Nonenzymatic polymerase-like template-directed synthesis of acyclic l-threoninol nucleic acid », Nature Communications, vol. 12, no 1, , p. 804 (ISSN 2041-1723, PMID 33547322, PMCID PMC7864931, DOI 10.1038/s41467-021-21128-0, lire en ligne, consulté le )
- (en) James Attwater et al., « Ice as a protocellular medium for RNA replication », Nature, (DOI 10.1038/ncomms1076, lire en ligne).
- Frédéric Thomas, Thierry Lefevre, Michel Raymond, Biologie évolutive, De Boeck supérieur, , p. 25.
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en) Walter Gilbert, The RNA World Nature 319 (1986): 618