Dryopsophus aureus
Litoria aurea · Rainette verte et dorée
- Rana aurea Lesson, 1827
- Litoria aurea Lesson, 1827
- Ranoidea jacksoniensis Tschudi, 1838
- Ranoidea resplendens Girard, 1853
- Fanchonia elegans Werner, 1893
- Hyla blandsuttoni Procter, 1924
- Hyla aurea ulongae Loveridge, 1950

VU A2ace : Vulnérable
La Rainette verte et dorée (Dryopsophus aureus, anciennement Litoria aurea) est une espèce d'amphibiens de la famille des Pelodryadidae. Cette grenouille est originaire de l'Est de l'Australie. En dépit de sa classification dans une famille de rainettes et de ses capacités d'escalade, elle ne vit pas dans les arbres et passe presque tout son temps au sol. Elle est de couleur dorée et verte, et peut atteindre jusqu'à 11 cm de long, ce qui en fait une des plus grandes grenouilles d'Australie.
Cette grenouille est vorace, se nourrissant principalement d'insectes mais aussi de proies plus grosses telles que des vers et des souris. Contrairement à la plupart des grenouilles, elle est active de jour, mais c'est surtout pour pouvoir se réchauffer au soleil. Elle a tendance à être moins active en hiver, sauf au cours des périodes plus chaudes ou humides, et se reproduit durant les mois les plus chauds. Les mâles atteignent la maturité sexuelle après environ neuf mois, tandis que les femelles, plus grandes, ne se reproduisent pas avant l'âge de deux ans. Les grenouilles peuvent se livrer au cannibalisme, et les mâles attaquent fréquemment leurs congénères s'ils empiètent sur leur territoire.
De nombreuses populations, en particulier dans la région de Sydney, vivent dans des zones fortement impactées par l'Homme, telles que des golfs, des friches industrielles ou des tas de briques. Bien qu'elle ait été auparavant l'une des grenouilles les plus courantes du Sud-Est de l'Australie, Dryopsophus aureus a vu sa population décliner ces dernières années, en particulier dans les zones montagneuses, ce qui conduit à son classement actuel d'espèce vulnérable. Ses effectifs continuent de baisser et elle est menacée par la perte et la dégradation de son habitat, la pollution, les espèces introduites, et divers parasites ou autres agents pathogènes comme Batrachochytrium dendrobatidis (un champignon aquatique). Comme la plupart des populations restantes vivent sur des terrains privés, la sauvegarde de l'espèce est difficile à mettre en place. Cette grenouille demeure tout de même abondante en Nouvelle-Zélande et dans plusieurs autres îles du Pacifique, où elle a été introduite.
Description
[modifier | modifier le code]

Dryopsophus aureus est une grenouille de grande taille : les adultes mesurent entre 4,5 et 11 cm de long, les mensurations les plus communes étant comprises entre 6 et 8 cm[1]. Les mâles mesurent de 57 à 69 mm et les femelles de 65 à 108 mm[2]. Dryopsophus aureus est donc l'une des plus grandes grenouilles australiennes[3]. Les mâles adultes sont généralement plus petits que les femelles. Cette grenouille peut présenter une coloration presque complètement verte, avec des nuances de vert foncé, vert émeraude vif, vert métallisé, brun cuivré terne ou même avec des marques dorées ou une coloration presque entièrement bronze[3],[4]. En général, les femelles ont moins de marques bronze que les mâles, et paraissent donc plus vertes, et elles présentent une gorge blanche quand celle des mâles est marron-jaunâtre ou grise[5]. Pendant les mois les plus froids (de mai à août), lorsque les grenouilles sont inactives, la coloration peut se foncer pour devenir presque noire[6]. Leur peau peut s'assombrir de la même manière si l'animal reste dans un endroit sombre pendant quelques minutes, et la coloration varie également au fil de la vie d'un animal[6]. Enfin on observe des différences entre les populations d'un site à l'autre. Ainsi à Port Kembla on observe une grande majorité de grenouilles presque uniformément vertes avec de petites marques bronze, tandis que dans le parc national de Yuraygir les marques bronze sont plus importantes et le vert est moins prédominant, sans que l'on en connaisse la cause exacte[7].
Une bande crème ou jaune pâle, avec une bordure dorée au-dessus et noire en dessous, s'étend derrière l'œil, passe juste au-dessus du tympan, qui est généralement de couleur cuivre, et se poursuit le long du corps jusqu'à l'aine. Une autre bande de la même couleur commence au-dessous de l'œil et continue jusqu'à l'épaule. L'abdomen est crème ou blanc, avec une texture granuleuse. Les pattes sont de couleur verte ou bronze, voire une combinaison des deux, et l'intérieur de la cuisse et l'aine sont bleu-vert[3],[4]. Les mâles adultes présentent des sacs vocaux jaunes[8]. Le tympan est distinct et ovale, et l'espèce possède l'extrémité des orteils de larges ventouses qui lui permettent d'escalader. Les doigts des pattes avant ne sont pas palmés, à la différence des orteils qui le sont presque entièrement[4]. Lors de la période de reproduction, les mâles développent des callosités nuptiales sur le pouce, qui leur permettent de tenir les femelles pendant l'accouplement. Elles sont brunes pendant la saison de reproduction, mais sont plus discrètes et plus pâles pendant le reste de l'année[8]. Pendant la saison de reproduction, les femelles développent une teinte bleuâtre sur leurs pattes, tandis que les jambes des mâles passent au orange rouille[9].
Éthologie
[modifier | modifier le code]Comportement
[modifier | modifier le code]
Comme les autres grenouilles arboricoles, Dryopsophus aureus passe beaucoup de temps immobile sur la végétation, les rochers, et les roseaux, au soleil et le plus souvent près de l'eau, ou alternant entre ces différents habitats[10]. Contrairement à la plupart des espèces de grenouilles, elle est souvent active pendant la journée. Lorsqu'on la manipule, cette espèce sécrète un mucus visqueux âcre[11], qui se compose de 17 peptides. Treize de ces molécules se révèlent être des antibiotiques à large spectre et des anticancéreux[12]. La sécrétion rend la grenouille glissante et donc difficile à attraper, et elle est toxique pour certaines autres espèces de grenouilles. Elle constitue donc un moyen de défense important pour Dryopsophus aureus[13]. Les combats entre mâles sont fréquents, se déclenchant dès que deux d'entre eux se retrouvent à moins d'un mètre l'un de l'autre. Ces combats peuvent causer d'importantes blessures[13].
Dryopsophus aureus peut parcourir de grandes distances en une journée ou une nuit, des trajets de 1 à 1,5 kilomètre ayant été enregistrés. Des spécimens équipés de balises ont parcouru jusqu'à 3 km, et peuvent s'éloigner de plusieurs kilomètres de la zone de reproduction la plus proche[14]. Une population a tout de même tendance à retourner ou à demeurer dans un lieu déterminé, à condition que l'habitat satisfasse toujours ses besoins, sans quoi elle en cherche un meilleur. Dryopsophus aureus préfère les habitats les plus complexes possibles, certainement pour lui assurer la meilleure protection[14]. En général, les grenouilles se satisfont d'une superficie de 100 à 700 m2. C'est une espèce bien adaptée à la vie terrestre : elle peut se réhydrater en absorbant l'humidité de son environnement par la peau de son ventre, et la perte d'eau par évaporation est très faible par sa peau plutôt étanche[15]. Certaines ont été observées à plus de 400 m d'un point d'eau[10].
Pendant l'hiver, la grenouille est très peu active et reste au même endroit, alors qu'elle se déplace pendant les mois les plus chauds en quête de nourriture et de partenaires sexuels. Par temps froid, les grenouilles semblent hiberner, puisque certaines ont été retrouvées dans un état de « torpeur », mais aucune étude physiologique n'a indubitablement montré que cette espèce hibernait[10]. Bien que la grenouille soit active pendant la journée, elle se contente généralement de quitter son abri pour se chauffer au soleil. Elle ne s'éloigne pas pour se nourrir et profite de quelques insectes qui peuvent passer à sa proximité[10].
La reproduction de Dryopsophus aureus dépend de la salinité et de la température de l'eau. La salinité affecte le développement et la métamorphose des têtards[16], et la reproduction est significativement réduite dans les étangs où la température est inférieure à 20 °C[15]. Les têtards peuvent tolérer des niveaux de salinité de 6 ‰, mais si celle-ci est supérieure ou égale à 8 ‰ cela conduit à une vitesse de croissance ralentie et un plus fort taux de mortalité[9]. D'un autre côté, un niveau de salinité d'au moins 1 à 2 ‰ peut être bénéfique pour Dryopsophus aureus car il détruit certains agents pathogènes tels que la chytridiomycose. Le pH de l'eau ne semble pas affecter l'éclosion des œufs s'il reste compris entre 4 et 10[15],[17].
Alimentation
[modifier | modifier le code]Les adultes sont voraces et peuvent manger des insectes comme les grillons, les larves de moustiques, les libellules, les blattes, les mouches ou les sauterelles[18]. Ils sont également friands d'écrevisses d'eau douce, de limaces, de lombrics et d'autres grenouilles, appartenant parfois à la même espèce[18]. Ils ont d'ailleurs une forte tendance au cannibalisme, et s'ils sont enfermés ensemble ils se dévorent les uns les autres. Des études et des essais dans la nature ont montré que ce phénomène existait également à l'état sauvage[18].
Les têtards se nourrissent de détritus, d'algues et de bactéries[19]. Les têtards ayant atteint des stades plus avancés de développement préfèrent les matières végétales, mais mangent également quelques toutes petites proies aquatiques. Les têtards maintenus en captivité sont nourris avec de la laitue bouillie et de la nourriture pour animaux de compagnie sous forme de granulés[19]. Si la densité de population est élevée, les têtards peuvent manger leurs congénères[10].
En captivité, Dryopsophus aureus se nourrit de grillons, de mouches, d'asticots, de vers à soie, de coléoptères, de vers de farine, de larves, de cloportes, de blattes, de mollusques, de criquets, d'araignées, d'escargots aquatiques, de lombrics et de souris. On a par ailleurs déjà observé une grenouille mangeant un petit serpent tigre[18]. Les grenouilles en captivité ont l'habitude de ne pas avaler des proies inertes, ce qui vaut à l'animal la réputation de manger tout ce qui bouge[18].
Les méthodes de chasse des grenouilles varient en fonction de leur taille. Les plus petits animaux encore en phase de croissance chassent de petits insectes volants en sautant pour les capturer. Les grenouilles adultes montrent une nette préférence pour les grands insectes terrestres et les autres grenouilles[18], mais elles consomment également des proies aquatiques dont les têtards. Les individus tout juste métamorphosés vont dans l'eau attraper des larves de moustiques[18]. La proportion relative de ces diverses proies au sein du régime de Dryopsophus aureus n'est pas connue précisément[19]. Les études menées sur des animaux en captivité ont montré que les grenouilles mangeaient nettement moins lorsque les températures étaient plus fraîches et les grenouilles sauvages semblent moins manger en période de reproduction[19]. Les jeunes grenouilles s'alimentent en plus grandes quantités pendant les mois les plus chauds afin de constituer des stocks, un comportement moins net chez les adultes[20].
Prédateurs et parasites
[modifier | modifier le code]
Les prédateurs de Dryopsophus aureus comprennent les échassiers, comme l'Aigrette sacrée, l'Aigrette à face blanche, l'Ibis à cou noir, et le Busard de Gould. Les serpents, les scinques, le Renard roux, les tortues, les anguilles et d'autres poissons comme la Perche commune, la Carpe commune et plusieurs espèces de goujons sont des prédateurs plus occasionnels de l'espèce[19],[21]. Des grenouilles adultes ont déjà été vues devenant la proie du Serpent noir à collier rouge, du Serpent-tigre[19], du Martin-chasseur géant et du Martin-chasseur sacré. D'autres échassiers et d'autres serpents comme Dendrelaphis punctulatus et les espèces du genre Austrelaps sont également soupçonnés d'être des prédateurs de cette grenouille[8]. L'importance relative des différents prédateurs menaçant cette grenouille et ses têtards n'est pas connue[19]. Avant que la grenouille ne devienne rare, et quand la chasse de subsistance était plus répandue, elle était chassée et consommée par les Aborigènes d'Australie. Elle a également été utilisée dans des travaux pratiques de dissection durant des cours de biologie et a été capturée par l'Homme pour nourrir des reptiles de compagnie[13].
Parmi la faune parasite trouvée chez D. aureus, toute sorte d'endoparasites helminthes ont été signalés[22] : l'acanthocéphale Porrorchis hylae, des cestodes (Triplotaenia mirabilis, Ligula sp. et Australotaenia hylae[23]), des trématodes (Tetracotyle sp., Mesocoelium mesembrinum, Australodiscus megalochrus, Gorgodera australiensis, Pleurogenoides solus, Dolichosaccus anartius, D. trypherus, Haematoloechus australis, des échinostomes et des strigéides indéterminés) et des nématodes (Falcaustra hylae, Parathelandros sp., Physaloptera confusa, Rhabdias hylae, R. nigrovenosum et Oswaldocruzia limnodynastes). En Nouvelle-Calédonie où l'amphibien est introduit, le nématode Angiostrongylus cantonensis a aussi été signalé[24]. Un myxozoaire, Myxobolus hylae, est décrit des organes génitaux de D. aureus[25]. Parmi les protistes, des ciliés du genre Nyctotherus ont été signalés[26], ainsi que des opalines, courantes dans l'intestin grêle de la grenouille, comme Protoopalina hylarum et P. australis[27].
Reproduction
[modifier | modifier le code]Accouplement
[modifier | modifier le code]
Dryopsophus aureus se reproduit pendant la période la plus chaude de l'année, d'octobre à mars, bien que quelques accouplements ont été observés en fin d'hiver. La reproduction est influencée par la géographie, les populations situées les plus au sud et les plus en altitude ont une période de reproduction plus courte que celles situées dans les plaines et plus au nord. Ces dernières commencent leur reproduction plus tôt et la finissent plus tard[8]. Durant la saison de reproduction, les mâles coassent la nuit, généralement alors qu'ils sont dans l'eau, mais aussi parfois dans la végétation au bord du point d'eau. Leur profond coassement en quatre « croaa » rappelle le son d'une mobylette changeant de vitesse[4],[8]. Les mâles répondent à un enregistrement de leur cri, et c'est pourquoi ils coassent généralement à l'unisson[8]. Ils coassent également plus volontiers dans certaines plages de température, notamment pour une température de l'eau entre 16 et 23 °C et une température de l'air entre 14 et 25 °C. Ils chantent aussi immédiatement après une averse[28].
Les mâles sont matures quand ils atteignent une taille de 45 à 50 mm, entre 9 et 12 mois, et ils développent alors une coloration grise à jaune brunâtre en dessous du menton. Ceci est un signe du développement du sac vocal, qui va permettre au mâle de pousser son chant[8]. Les femelles atteignent la maturité sexuelle à deux ans, à condition qu'elles aient atteint la taille de 65 mm sans quoi elles ne sont pas vues en amplexus. Elles atteignent généralement cette taille la seconde année après leur métamorphose[29]. Les femelles perdent 26 % de leur poids au moment de la ponte. Les mâles perdent également du poids durant la période de reproduction car ils passent moins de temps à se nourrir[28]. Le poids perdu pendant la saison de reproduction est généralement repris entre janvier et septembre[30].
L'amplexus entre le mâle et la femelle a généralement lieu dans l'eau, mais peut aussi avoir lieu sur la terre ferme à une distance assez importante d'un point d'eau. Des observations sur les sites de reproduction ont montré que les mâles y passaient plus de temps, cherchant une femelle pour s'accoupler, tandis que les femelles préféraient demeurer à d'autres endroits pour trouver de la nourriture avant de se rendre sur le site de reproduction pour s'accoupler. Durant l'amplexus, le mâle attrape la femelle au niveau des aisselles après être monté sur son dos[8],[28]. Dans la nature, l'amplexus dure entre dix minutes et cinq jours. Des amplexus provoqués en laboratoire ont duré jusqu'à 50 heures[28]. Parfois, l'amplexus n'est pas suivi d'une ponte[28].
Ponte
[modifier | modifier le code]Le couple se déplace d'environ 100 m durant l'amplexus avant que la femelle ne ponde ses œufs[28]. Durant la ponte, le couple reste en amplexus et le mâle fertilise les œufs avec son sperme. Les mâles font parfois des mouvements avec leurs pattes arrière pendant ce temps, vraisemblablement pour accélérer la fécondation. La ponte et la fertilisation prennent environ cinq minutes[28]. En moyenne, 5 000 œufs sont pondus dans la végétation aquatique, formant une masse gélatineuse. Une ponte comptant 11 682 œufs a déjà été enregistrée et constitue le record[31]. La femelle se déplace en déposant ses œufs, laissant derrière elle une trainée gélatineuse qui s'emmêle parfois[6]. La masse d'œufs flotte lorsqu'elle est juste pondue, puis coule au bout de 12 heures, ou si elle est touchée[15]. Les œufs se distinguent de ceux des autres espèces de grenouilles : ils mesurent 2 à 2,5 cm de diamètre et sont bicolores, noirs à une extrémité et blancs à l'autre[6]. Ils grossissent rapidement après la ponte, atteignant rapidement 4 mm, avant de couler. Dans les minutes qui suivent la ponte, ils flottent avec la partie noire pointant vers le haut, mais après avoir coulé leur orientation devient aléatoire[6]. Deux à cinq jours plus tard, les têtards éclosent, mais cela peut se produire au bout de seulement quelques heures dans quelques rares cas[15]. Le taux d'éclosion varie entre 46 et 77 %, et est maximum si la température est de 22 °C. L'éclosion est également moins bonne en eau acide, alors qu'une eau alcaline ne dégrade pas son taux. Étant donné le nombre d'œufs qui éclosent par femelle et la rareté des grenouilles adultes, le taux de survie des têtards semble très faible[32].
Développement des jeunes
[modifier | modifier le code]Au moment de leur éclosion, les têtards mesurent 2,5 à 3 mm sans la queue, et 5 à 6 mm en l'incluant. Les têtards en captivité ont une croissance exponentielle : ils passent de 3 à 9 mm en cinq semaines, et leur taille triple encore durant les cinq semaines suivantes[15]. La croissance est de 0,2 mm par jour pendant les cinq premières semaines[15]. Les têtards de Dryopsophus aureus sont grands, atteignant 80 mm de long[4], bien que leur taille varie assez fortement d'un individu à l'autre et qu'ils puissent être plus petits[33]. Le corps est généralement aussi large que profond. La nageoire a une teinte jaune et est très arquée[6]. Le corps est jaune translucide avec des marques plus sombres au niveau de l'abdomen. Juste avant que ses pattes ne se développent, le têtard prend la coloration verte qu'il conservera une fois adulte[6]. Les têtards nagent généralement dans les 30 cm d'eau sous la surface, ou restent immobiles sur le fond. Ils se déplacent souvent en groupe à la manière des bancs de poissons[30].
À la fin du développement du têtard, les pattes arrière commencent à apparaître, et cette phase du développement de la grenouille se termine avec la formation des pattes avant, juste avant la métamorphose. Celle-ci a généralement lieu entre octobre et avril, en lien avec la période de reproduction, mais on peut trouver des têtards pendant toute l'année, et il semble donc que certains passent l'hiver sous cette forme. Ce phénomène est aussi bien observé dans la nature qu'en captivité. Le têtard reste sous cette forme pendant dix à douze semaines en règle générale, mais cette phase peut durer entre cinq semaines et un an. Les têtards qui croissent le plus lentement sont ceux que l'on observe durant l'hiver, et la température pourrait donc être corrélée avec la vitesse de croissance. Par contre, il n'y a pas réellement de différences de croissance en fonction du pH, du moment qu'il soit compris entre 4 et 9. Durant les quatre premières semaines, la croissance ne semble pourtant pas se détériorer si elle se déroule entre 18 et 26 °C, mais par la suite elle est fortement réduite si la température n'est que de 18 °C[15]. Au début de la métamorphose, tous les membres sont présents, de même que la queue. Au cours de cette phase, cette dernière se résorbe, et le seul autre changement visible est la fermeture de l'évent. Les têtards en métamorphose mesurent généralement entre 22 et 28 cm[15], et terminent leur métamorphose entre deux et onze mois, en fonction de la température de l'eau et de la disponibilité en nourriture[34]. Ce processus est ralenti aux basses températures[29], mais il prend généralement entre trois et huit jours après que le têtard a fini son développement[35]. La ponte a souvent lieu dans des endroits où il n'y a pas de poissons prédateurs, particulièrement dans des points d'eau temporaires. Toutefois, les populations du Victoria pondent aussi souvent dans des étangs permanents que dans des points d'eau temporaires[36].
Les métamorphes ressemblent aux adultes et mesurent en moyenne 2,6 cm de long[29]. Ils quittent rapidement le site de reproduction, notamment s'il y a une source de nourriture à proximité. Cette tendance à migrer précocement peut s'expliquer par une forte tendance au cannibalisme des grenouilles adultes qui mangent les plus petites[14]. Une fois métamorphosée, la grenouille fait la même taille que le métamorphe. Elle croît ensuite rapidement pour atteindre 45 mm au bout de deux mois, et 50 à 60 mm au bout de six mois, avant que cette croissance ne ralentisse[35]. Une fois que la grenouille a atteint la maturité sexuelle, la croissance devient très lente[35].
Les jeunes tout juste métamorphosés pèsent 2 g tandis que les plus gros adultes peuvent atteindre 50 g. Une même grenouille peut voir son poids varier fortement suivant la quantité de graisse qu'elle stocke, la quantité de nourriture ingérée récemment et si elle a des œufs qui se forment ou non[28]. Dryopsophus aureus vit entre 10 et 15 ans en captivité, mais sa longévité dans la nature est mal connue[29].
Répartition et habitat
[modifier | modifier le code]Répartition
[modifier | modifier le code]

Dryopsophus aureus est originaire du Sud-Est de l'Australie. Avant que sa population ne décline, son aire de répartition s'étendait de Brunswick Heads, dans le nord de la Nouvelle Galles du Sud, à l'est du Gippsland, dans le Victoria[36] et s'étendait à l'ouest jusqu'à Bathurst, Tumut et le Territoire de la capitale australienne[37].
La répartition actuelle de Dryopsophus aureus va de Byron Bay, dans le nord de la Nouvelle-Galles du Sud, à l'Est du Gippsland, dans le Victoria, et les populations se concentrent surtout le long de la côte[38]. En Nouvelle-Galles du Sud, ses effectifs ont considérablement diminué en nombre et leur répartition s'est réduite depuis les années 1960, et même si ce phénomène n'a pas eu lieu dans le Victoria, on a observé en Nouvelle-Galles du Sud que cette grenouille avait disparu de toutes les zones montagneuses situées à plus de 250 m d'altitude, à l'exception de la population de Captains Flat. Une étude des populations du littoral de la Nouvelle-Galles du Sud a indiqué que de nombreuses populations sont très réduites, avec moins de 20 adultes. Selon une étude réalisée en 1996, six populations de plus de 300 grenouilles sont connues : deux dans la région métropolitaine de Sydney, deux dans la zone d'administration locale de Shoalhaven, et deux sur la côte centre-nord de Nouvelle-Galles du Sud[1]. Il n'y a maintenant plus qu'environ 40 sites, au total, où on peut trouver cette espèce, et la plupart se trouvent dans la région de Sydney[33]. Dryopsophus aureus a disparu d'environ 90 % de son ancienne aire de répartition[39]. Certains spécimens ont été observés à Armidale, mais il s'est avéré qu'il s'agissait d'une erreur d'identification de L. castanea[33]. Dans le Victoria, le déclin a été moins prononcé, et a surtout concerné les régions à l'intérieur des terres où l'habitat de la grenouille a disparu[40]. Dryopsophus aureus survit dans certaines régions de Sydney, comme dans le Brickpit au Sydney Olympic Park. Le site a été proposé pour accueillir les courts de tennis lors des Jeux olympiques de Sydney en 2000. Lorsque Dryopsophus aureus a été trouvée là, la décision a été prise de construire les courts de tennis ailleurs, et la population bénéficie d'un suivi. Cette grenouille est devenue une mascotte officieuse de la zone de la baie d'Homebush[41]. Elle a également été introduite sans grand succès dans divers endroits de Sydney où on retrouvait son habitat naturel[40].
Dryopsophus aureus occupe trois îles au large de la côte est de l'Australie : l'île Kooragang, l'île Broughton au large de Port Stephens et l'île Bowen à Jervis Bay[38],[39]. Elle a été introduite en Nouvelle-Zélande dans les années 1860, et y est désormais courante sur l'île du Nord au nord de Rotorua. Dans la plupart des endroits où on rencontre cette espèce, il s'agit de la seule espèce de grenouille[40]. Toutefois, une récente baisse des effectifs a été signalée sur cette île, qui pourrait être liée à la prédation de certains poissons. Elle a été introduite dans divers îles du Pacifique comme en Nouvelle-Calédonie et à Vanuatu au XIXe siècle et y est devenue commune[38],[40].
On ne trouve pas de différences notables entre des populations de Dryopsophus aureus éloignées géographiquement, ou du moins ces variations ne sont pas aussi importantes que les variations au sein d'une même population[5]. Les femelles sont plus susceptibles de se trouver loin des sites de reproduction, alors que les mâles les quittent rarement. Le sex-ratio des jeunes est équilibré. Les juvéniles sont plus rarement observés que les adultes, sans que l'on sache si cela traduit une plus faible abondance ou un comportement plus discret[32].
Habitat
[modifier | modifier le code]Dryopsophus aureus occupe un large éventail d'habitats différents. Elle est généralement associée aux marécages côtiers, aux zones humides, aux marais, aux barrages, aux fossés, aux rivières et aux forêts, mais certaines populations ont également été observées sur d'anciens sites industriels (par exemple, le Brickpit). Cette espèce rentre parfois dans les habitations humaines, et peut être retrouvée dans des baignoires[9]. Il est difficile de déterminer ses exigences exactes en matière d'habitat, du fait de cette grande variété d'habitats qui semblent lui convenir. Les exigences de son habitat ont été difficiles à déterminer, car il a été trouvé dans un large éventail de plans d'eau, à l'exception des rivières à courant rapide[42]. Elle affectionne particulièrement les étangs d'eau douce formés récemment qui sont peu profonds, sans ombrage et non pollués, et elle évite les eaux où vivent des poissons prédateurs indigènes ou introduits[38]. Cependant, elle est également fréquentes dans des zones altérées par les activités humaines[15]. La grenouille préfère les plans d'eau avec une végétation de roseaux et de joncs, dans lesquels elle se réchauffe au soleil, tandis que ses abris hivernaux sont constitués de végétaux, rochers, déchets ou débris jetés par l'Homme, présents à proximité de la zone de reproduction. Des zones herbeuses sont généralement situées à proximité de son habitat et constituent des aires d'alimentation privilégiées[38],[20]. Elle préfère les cours d'eau au fond sableux, rocailleux ou argileux, et est peu sensible au niveau de turbidité de l'eau, au pH, au taux d'oxygène et à la température, même si ces paramètres peuvent limiter sa croissance s'ils ne sont pas optimaux[9]. Bien que ses pattes lui offrent beaucoup d'adhérence, la grenouille grimpe peu aux arbres. Elle passe le plus clair de son temps dans les 10 cm au-dessus du sol et s'aventure rarement à plus d'un mètre de haut[10].
Taxinomie
[modifier | modifier le code]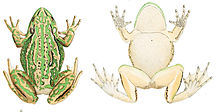
Dryopsophus aureus présente de nombreuses caractéristiques physiques et comportementales représentatives des Ranidae, d'où son classement initial dans le genre Rana. Elle a un museau pointu, de longues pattes arrière et des orteils presque totalement palmés. Le tympan est grand et distinct, et la forme générale du corps est similaire à de nombreuses espèces de Rana. Comme beaucoup de grenouilles du genre Rana, Dryopsophus aureus est principalement aquatique, et ne se déplace sur terre que pendant les périodes de pluie. Elle a été retirée du genre en raison de différences anatomiques avec la famille des Ranidae. En effet, la structure des os et du cartilage de Dryopsophus aureus est plus proche de celle des espèces de la famille des Hylidae, d'où son reclassement parmi ceux-ci, parmi le genre Hyla provisoirement avant que ne soit créé le genre Litoria pour les animaux d'Australie et de Papouasie, sur la base d'une musculature du sac vocal différente[43]. En 2016, elle est placée dans le genre Dryopsophus par Duellman, Marion et Hedges ; dans le même temps la sous-famille des Pelodryadinae des Hylidae est élevée au rang de famille, les Pelodryadidae[44],[45].
Dryopsophus aureus a été décrite pour la première fois sous le nom Rana aurea par Lesson en 1827. Sa dénominaiton a ensuite changé 20 fois, avant que l'espèce ne soit nommée Litoria aurea par Günther en 1844, et elle change encore 9 fois avant d'être nommée à nouveau Litoria aurea[46]. L'épithète aurea derive du latin aureus signifiant « or »[47]. L'espèce est maintenant classée dans le complexe de Dryopsophus aureus, un groupe d'espèces de grenouilles étroitement liées appartenant au genre Dryopsophus[48]. Les représentants de ce groupe sont dispersés dans toute l'Australie : trois espèces vivent dans le sud-est du pays, une dans le nord et deux dans le sud-ouest[48]. Les espèces qui le composent sont Dryopsophus aureus, Dryopsophus raniformis, Litoria castanea, Dryopsophus dahlii, Dryopsophus cyclorhynchus et Dryopsophus moorei[48]. Les aires de répartition de D. raniformis et D. castanea chevauchent celle de Dryopsophus aureus. Comme par ailleurs ces espèces se ressemblent, il peut être parfois difficile de les distinguer. D'ailleurs, jusqu'en 1972, D. raniformis et Dryopsophus aureus étaient considérées comme une seule et même espèce, avant que les études électrophorétiques ne révèlent leurs différences[49]. D. castanea n'a pas été vue depuis 1980, et est peut-être éteinte à l'heure actuelle. Les grandes taches jaunes présentes sur ses cuisses la distinguent pourtant assez facilement de Dryopsophus aureus. D. raniformis, qui est très semblable à Dryopsophus aureus, peut seulement en être distinguée par les bosses présentes sur son dos. Certaines populations de D. aureus situées près d'Ulong, en Nouvelle-Galles du Sud, pourraient former une sous-espèce distincte, D. a. ulongae, mais cela n'est pas unanimement accepté[49]. Dryopsophus aureus est liée de manière étroite et similaire à L. castanes et L. ranaformis. Elle s'est séparée de ces deux espèces il y a environ 1,1 million d'années. Les scientifiques pensent que ces différentes espèces peuvent encore s'hybrider, comme leurs aires de répartition se chevauchent, et L. raniformis et L. aurea ont toutes deux été vues près des étangs de la région de Gippsland dans le Victoria[49]. Cependant, aucun hybride n'a été identifié de manière sûre. Des grenouilles d'apparence intermédiaire entre les deux espèces ont été observées mais l'étude des protéines et du sérum de ces grenouilles a montré qu'elles appartenaient à l'une ou l'autre des deux espèces[5]. Malgré d'autres zones de cohabitation, aucune preuve d'hybridation n'y a été répertoriée[5].
Menaces et mesures de protection
[modifier | modifier le code]Menaces sur l'espèce
[modifier | modifier le code]
Les effectifs de Dryopsophus aureus semblent avoir décliné de plus de 30 % ces dix dernières années[38]. L'espèce est classée comme « vulnérable », et même « menacée » par le New South Wales Threatened Species Conservation Act de 1995[39]. Bien qu'elle ne soit classée que comme « vulnérable » sur le plan national, le National Frog Action Plan considère Dryopsophus aureus comme « menacée »[50]. Au contraire du cas de l'Australie, Dryopsophus aureus est très répandue en Nouvelle-Zélande où elle n'est pas protégée[50].
Plusieurs facteurs peuvent expliquer le fort déclin de l'espèce en Australie, comme la fragmentation de son habitat, l'érosion et la sédimentation des sols, la contamination des eaux par les insecticides et les fertilisants[51], l'introduction de poissons prédateurs ou l'altération des écoulements d'eau par les activités humaines[39]. Le déclin de la population semble lié à l'introduction de Gambusia affinis[39], une espèce de poisson originaire d'Amérique du Nord qui a été introduite pour contrôler la population de larves de moustiques[52]. Des études ont montré que les œufs et les têtards de Dryopsophus aureus étaient des proies très courantes pour ces poissons[39], et dans 77 des 93 sites de Nouvelle Galles du Sud desquels Dryopsophus aureus a disparu avant 1990 cette espèce de poissons est présente. Dryopsophus aureus vit dans les points d'eau où l'on trouve ce poisson, mais la reproduction y est rarement réussie, certainement du fait de la voracité de ce poisson envers les œufs et les têtards[21]. Gambusia affinis n'est pas présent dans l'est du Victoria, où les effectifs de Dryopsophus aureus demeurent stables, mais le poisson va vraisemblablement coloniser les rivières de cette région à l'avenir, et menacer la population de grenouilles[53],[54].
Cette espèce est également menacée par certaines espèces de mammifères introduites comme les chats et les renards, l'altération de la qualité de l'eau au niveau de ses sites de reproduction[39], l'utilisation d'herbicides[51] et la disparition d'une partie de son habitat par la destruction des zones humides[39]. La maladie fongique causée par Chytridiomycosis et qui touche les amphibiens pourrait également être une cause du déclin des effectifs[39] mais l'importance relative de ce facteur dans la diminution de la population demeure inconnue[55]. Les grenouilles sont peut-être devenues plus sensibles, sans que le champignon ne soit plus répandu[56]. La variabilité génétique est peu importante au sein de l'espèce, du fait de la destruction de l'habitat de la grenouille qui a isolé de nombreuses populations qui sont contraintes de se reproduire en consanguinité. C'est pourquoi une intervention humaine a été proposée pour déplacer certaines grenouilles d'une population à l'autre et ainsi opérer à un brassage génétique qui pourrait améliorer la vitalité des animaux et leur taux de survie[54],[57].
Le cannibalisme est considéré par certains comme une cause du déclin dans certaines zones, les plus petits têtards pouvant être toxiques[19]. D'autres causes hypothétiques du déclin sont proposées comme les radiations ultraviolettes causées par le trou dans la couche d'ozone, le réchauffement de la planète et la sécheresse croissante. La première de ces hypothèses a été testée par une étude mais sans résultat concluant. Le réchauffement de la planète ne semble pas être réellement une cause du déclin car les extrémités nord et sud de l'aire de répartition de la grenouille n'ont pas bougé[56].
Mesures de sauvegarde
[modifier | modifier le code]
Dryopsophus aureus a été le sujet de diverses recherches et d'une surveillance permanente, éléments importants pour améliorer sa sauvegarde. Les recherches ont surtout porté sur les méthodes qui pourraient être employées pour éviter la propagation de Gambusia affinis[39]. On a notamment tenter d'empoisonner ce poisson, avec des résultats mitigés, ou d'introduire des prédateurs[54]. D'autres stratégies pour assurer la survie de l'espèce consistent à assurer le développement d'habitats convenables pour qu'elle se reproduise dans de bonnes conditions. Des efforts sont également réalisés pour sensibiliser le grand public à ce problème[39]. La sauvegarde de l'espèce est difficile car seulement 20 % des populations connues en Nouvelle Galles du Sud depuis 1990 sont localisées dans des zones protégées. Parmi les huit populations que l'on trouve dans des zones protégées, seulement cinq ont un territoire entièrement inclus dans la zone et une d'entre elles ne s'y reproduit pas[53]. Des appels sont donc régulièrement lancés pour introduire des lois empêchant la dégradation de l'habitat de cette grenouille sur les terres privées[54]. Pour faire pression sur les pouvoirs publics, des groupes d'action ont été créés sous le nom de « Friends of the Green and Golden Bell Frog »[58]. Le grand public étant de plus en plus au fait des problèmes qui touchent cette espèce, les documentaires et actualités sur son déclin sont de plus en plus fréquents dans les médias et les références à cette grenouille sur les logos environnementaux sont courantes[59]. Les efforts de sensibilisation du grand public au problème de cette grenouille ont été facilités par le fait que ses couleurs sont les couleurs de l'Australie[60], en faisant un animal symbolique. Des restrictions concernant l'accès aux zones habitées par cette grenouille ont été mises en place[61]. Comme Dryopsophus aureus est majoritairement présente dans des zones où l'homme est lui aussi présent, ce genre de restrictions ciblées parait un bon moyen d'améliorer son habitat[54].
En 1998, un travail d'élevage en captivité est lancé par le zoo de Taronga à Sydney, sponsorisé par ASX Frog Focus. Le but de ce programme est d'aider à préserver les populations de Dryopsophus aureus dans la région de Sydney. Il consiste en la capture d'animaux, leur élevage en captivité et le lâcher dans la nature d'un grand nombre de têtards. Par ailleurs des efforts sont faits pour améliorer les habitats naturels et pour surveiller la population et l'évolution de ses effectifs[62]. Ce programme était initialement nommé « Frog Focus Botany », car Botany était le principal site concerné. Des milliers de têtards ont été relâchés dans un site de la réserve de Sir Joseph Banks[62]. Le programme a depuis été étendu à plusieurs autres zones. Entre 1998 et 2004 des têtards ont été relâchés dans des points d'eau bien ciblés sur la Long Reef Golf Course à Collaroy au nord de Sydney, avec peu de succès[17],[60]. Bien que Dryopsophus aureus ait été autrefois présente dans cette zone, la population a depuis complètement disparu. Quelques mâles matures sont aperçus de temps à autre[17], mais aucune population se reproduisant n'y est installée[17]. Une tentative de réintroduction à Marrickville a été réduite à néant par la chytridiomycose[17].
Annexes
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- René Primevère Lesson, « Grenouille bande d'or », dans Voyage autour du Monde, Exécuté par Ordre du Roi, Sur la Corvette de Sa Majesté, La Coquille, pendant les années 1822, 1823, 1824 et 1825, t. II : Zoologie, (lire en ligne), p. 60-61.
- (en) M. Anstis, Tadpoles of South-eastern Australia, Sydney, Reed New Holland,
- (en) J. Barker, G.C. Grigg et M.J. Tyler, A Field Guide to Australian Frogs, Surrey Beatty & Sons,
- (en) L. Egerton, Encyclopedia of Australian wildlife, Reader's Digest, (ISBN 1-876689-34-X)
- (en) M. Mahony, « Review of the declines and disappearances within the bell frog species group (Litoria aurea species group) in Australia », Declines and disappearances of Australian frogs, Canberra: Environment Australia, , p. 81-93
- (en) G Pyke et A White, « A Review of the Biology of the Green and Golden Bell Frog Litoria aurea », Australian Zoologist, vol. 31, no 4, , p. 563–598
- (en) M. Robinson, A Field Guide to Frogs of Australia, Sydney, Australian Museum/Reed New Holland,
- (en) « Frogs of Australia - Litoria aurea » (consulté le )
- (en) « Frogs Australia Network, Australian Frog Database - Litoria aurea » (consulté le )
- (en) Gillespie et al., « Litoria aurea », (consulté le )
- (en) « Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829) » (consulté le )
Liens externes
[modifier | modifier le code]- (en) Référence Amphibian Species of the World : Dryopsophus aureus (Lesson, 1829) (consulté le )
- (en) Référence AmphibiaWeb : espèce Litoria aurea (consulté le )
- (en) Référence Animal Diversity Web : Litoria aurea (consulté le )
- (en) Référence Fonds documentaire ARKive : Litoria aurea (consulté le )
- (en) Référence BioLib : Litoria aurea (Lesson, 1826)
- (en) Référence Catalogue of Life : Litoria aurea (Lesson, 1827) (consulté le )
- (fr) Référence INPN : Litoria aurea (Lesson, 1826) (TAXREF) (consulté le )
- (fr + en) Référence ITIS : Litoria aurea (Lesson, 1827) (consulté le )
- (en) Référence NCBI : Litoria aurea (taxons inclus) (consulté le )
- (en) Référence UICN : espèce Litoria aurea (Lesson, 1830) (consulté le )
Notes et références
[modifier | modifier le code]- (en) A.W. White et G.H. Pyke, « Distribution and conservation status of the Green and Golden Bell Frog Litoria aurea in New South Wales. », Australian Zoologist, vol. 30, , p. 177–189.
- Tyler & Knight, 2011 : Field Guide to the Frogs of Australia: Revised Edition. Csiro Publishing, p. 1-188.
- Egerton 2005, p. 381.
- (en) « Litoria aurea », Frogs Australia Network, (consulté le ).
- Pyke et White, p. 569.
- Pyke et White, p. 565.
- (en) Ross L. Goldingay et David A. Newell, « Population estimation of the Green and golden bell frog Litoria aurea at Port Kembla », Australian zoologist, Southern Cross University, vol. 33, , p. 210-216 (lire en ligne).
- (en) « Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829) » (consulté le ).
- Pyke et White, p. 570.
- Pyke et White, p. 575.
- (en) J. Barker, G.C. Grigg et M.J. Tyler, A Field Guide to Australian Frogs - The Litoria aurea complex, Surrey Beatty & Sons., , p. 99.
- (en) Tomas Rozek, Kate L. Wegener, John H. Bowie, Ian N. Olver, John A. Carver, John C. Wallace et Michael J. Tyler, « The antibiotic and anticancer active aurein peptides from the Australian Bell Frogs Litoria aurea and Litoria raniformis the solution structure of aurein 1.2. », The FEBS Journal. (consulté le ).
- Pyke et White, p. 578.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 31.
- Pyke et White, p. 571.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 35.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 34.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 27.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 28.
- Pyke et White, p. 577.
- Pyke et White, p. 19.
- (en) « Host-parasite database - Hyla aurea (ou Litoria aurea) », Londres, Natural History Museum (consulté le )
- (en) Sophie de Chambrier et Alain de Chambrier, « Two new genera and two new species of proteocephalidean tapeworms (Eucestoda) from reptiles and amphibians in Australia », Folia Parasitologica, vol. 57, no 4, , p. 263–279 (ISSN 0015-5683, DOI 10.14411/fp.2010.033)
- (en) Lawrence R. Ash, « The occurrence of Angiostrongylus cantonensis in frogs of New Caledonia with observations on paratenic metastrongyles », Journal of Parasitology, vol. 54, , p. 432-436
- (en) Thomas Harvey Johnston et M.J. Bancroft, « A parasite, Myxobolus hylae sp. nov. of the reproductive organs of the golden swamp frog, Hyla aurea », Australian Zoology, vol. 1, , p. 171-175
- (en) Thomas Harvey Johnston et J. Burton Cleland, « The haematozoa of Australian batrachians. No. I », Journal and proceedings of the Royal Society of New South Wales, vol. 44, , p. 406-415 (lire en ligne)
- (en) Maynard M. Metcalf, « The opalinid ciliate infusorians », Bulletin of the United States National Museum, vol. 120, , p. 1-484 (lire en ligne)
- Pyke et White, p. 573.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 30.
- Pyke et White, p. 574.
- (en) T.F. Van de Mortel et R. Goldingay, « Population assessment of the endangered Green and Golden Bell Frog Litoria aurea at Port Kembla, New South Wales », Australian Zoologist, vol. 30, , p. 398–404.
- Pyke et White, p. 579.
- Pyke et White, p. 566.
- (en) G. Daly, « Observations on the Green and Golden Bell-Frog Litoria aurea (Anura: Hylidae) », Herpetofauna, vol. 25, , p. 2–9.
- Pyke et White, p. 572.
- (en) G.R. Gillespie, « Distribution, habitat and conservation status of the Green and Golden Bell Frog Litoria aurea (Lesson, 1829) (Anura: Hylidae) in Victoria. », Australian Zoologist, vol. 30, , p. 199–207.
- (en) W.S. Osborne, M.J. Littlejohn et S.A. Thomson, « Former distribution and apparent disappearance of the Litoria aurea complex from the Southern Tablelands of New South Wales and the Australian Capital Territory. », Australian Zoologist, vol. 30, , p. 190–198.
- UICN, consulté lors d'une mise à jour du lien externe
- (en) Litoria aurea — Green and Golden Bell Frog Glossary, « Litoria aurea — Green and Golden Bell Frog », Environment.gov.au (consulté le ).
- Pyke et White, p. 567.
- (en) « Whatever happened to our Olympic Bell Frog? », Sydney Olympic Park Authority (consulté le ).
- (en) « Habitat requirements for the green and golden bell frog Litoria aurea (Anura: Hylidae) - Pyke, GH; White, AW - Australian Zoologist. May 1996. » (consulté le ).
- (en) S.A. Thornson, M.J. Littlejohn, W.A. Robinsont et W.S. Osbome, « Taxonomy of the Litoria aurea complex: a re-evaluation of the Southern Tableland populations of the Australian Capital Territory and New South Wales », Australian Zoologist, vol. 30, , p. 158-169
- (en) William E. Duellman, Angela B. Marion et S. Blair Hedges, « Phylogenetics, classification, and biogeography of the treefrogs (Amphibia: Anura: Arboranae) », Zootaxa, vol. 4104, no 1, , p. 1 (ISSN 1175-5334, DOI 10.11646/zootaxa.4104.1.1, lire en ligne)
- Amphibian Species of the World, consulté lors d'une mise à jour du lien externe
- (en) « American Museum of Natural History, Amphibian Species of the World - Synonyms of Litoria aurea » (consulté le ).
- (en) D.P. Simpson, Cassell's Latin Dictionary, Londres, Cassell Ltd., , 5e éd. (ISBN 0-304-52257-0), p. 883.
- Mahony 1999, p. 82.
- Pyke et White, p. 568.
- Pyke et White, p. 585.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 40.
- (en) « Australianmuseum » (consulté le ).
- Pyke et White, p. 586.
- Pyke et White, p. 587.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 37-40.
- Pyke et White, p. 582.
- Pyke et White, p. 583.
- Pyke et White, p. 589.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 41.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 42.
- Draft Recovery Plan for Green and Golden Bell Frog Litoria aurea (Lesson 1829), p. 33.
- (en) « Taronga and Western Plains Zoo - Frog Focus Botany » (consulté le ).

