Acide hyponitreux
| Acide hyponitreux | |
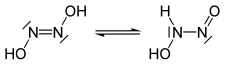 Tautomères de l'acide hyponitreux |
|
| Identification | |
|---|---|
| Nom UICPA | diazènediol |
| Synonymes |
Hyponitrite |
| No CAS | |
| PubChem | 61744 |
| ChEBI | 14428 |
| Propriétés chimiques | |
| Formule | H2N2O2 [Isomères] |
| Masse molaire[1] | 62,028 1 ± 0,001 1 g/mol H 3,25 %, N 45,16 %, O 51,59 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'acide hyponitreux est un composé chimique de formule H2N2O2. Sa formule semi-développée peut s'écrire HON=NOH, dimère du nitroxyle HNO et isomère du nitramide H2N–NO2. Il se présente sous forme d'un solide blanc cristallisé, explosif lorsqu'il est suffisamment déshydraté. En solution aqueuse, l'acide hyponitreux est un acide faible (pK1 = 7,21, pK2 = 11,54). Il se décompose en protoxyde d'azote N2O et en eau H2O avec une demi-vie de 16 jours à pH = 1 à 3 :
Cette réaction n'étant pas réversible, on ne peut considérer le protoxyde d'azote comme l'anhydride de l'acide hyponitreux.
L'acide hyponitreux forme deux séries de sels : les hyponitrites acides, qui contiennent l'anion [HON=N]−, et les hyponitrites, qui contiennent l'anion [ON=NO]2−. Ce dernier peut être préparé en solution aqueuse par deux méthodes. La première utilise des nitrites organiques pour former le sel de sodium de l'acide hyponitreux :
Une autre méthode est la réduction du nitrite de sodium NaNO2 pour donner le sel d'argent :
L'addition d'ions Ag+ provoque la précipitation de l'hyponitrite d'argent Ag2N2O2. L'acide hyponitreux est alors libéré par action du chlorure d'hydrogène HCl anhydre :
L'acide hyponitreux peut adopter une configuration cis ou trans ; l'hyponitrite de sodium hydraté Na2N2O2·5H2O, qui est solide, a une configuration trans, de même que l'acide libre. La forme cis peut être obtenue sous forme d'hyponitrite de sodium Na2N2O2 en chauffant de l'oxyde de sodium Na2O en présence de protoxyde d'azote N2O gazeux.
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
