Protéine de liaison à la vitamine D
| GC | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
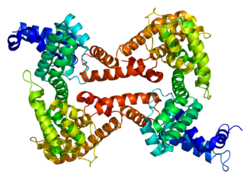 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure de la protéine GC. Basé sur l'identification PDB 1j78. | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifiants | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | GC, Protéine de liaison à la vitamine D, Vitamine D-binding protein, DBP, gc-globuline | ||||||||||||||||||||||||||||||||||||||||||||||||||
| IDs externes | OMIM: 139200 MGI: 95669 HomoloGene: 486 GeneCards: GC | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La protéine de liaison à la vitamine D ou vitamine D-binding protein (DBP), aussi à l'origine connue comme gc-globuline, est une protéine codée chez l'humain par le gène GC situé sur le chromosome 4 humain[5],[6].
Structure[modifier | modifier le code]
La protéine de liaison à la vitamine D est une alpha-globuline glycosylée d'environ 58 kDa. Ses 458 acides aminés sont codés par 1690 nucléotides sur le chromosome 4 (4q11q13). Sa structure primaire contient 28 résidus cystéine formant de multiples ponts disulfures. La protéine de liaison à la vitamine D possède trois domaines protéiques : le domaine 1 est composé de 10 hélices alpha, le domaine 2 de 9 et le domaine 3 de 4[7],[8].
Fonction[modifier | modifier le code]
La protéine de liaison à la vitamine D appartient à la famille des albumines, tout comme l'albumine sérique humaine (ou sérumalbumine) et l'alpha-fœtoprotéine. C'est une protéine multifonctionnelle qui se trouve notamment dans le plasma, le liquide ascitique, le liquide céphalo-rachidien et à la surface de nombreux types de cellules.
La protéine de liaison à la vitamine D peut lier les différentes formes de la vitamine D, parmi lesquelles l'ergocalciférol (vitamine D2) et le cholécalciférol (vitamine D3), les formes 25-hydroxylées (par exemple le 25-hydroxycholécalciférol) et la forme active 1,25-dihydroxycholécalciférol (calcitriol). La majeure partie de la vitamine D dans le sang est liée à cette protéine. Elle transporte les métabolites de la vitamine D entre la peau, le foie et les reins, puis sur les différents tissus cibles[9].
Elle se lie également à des acides gras ou à des monomères d'actine[10].
Synthèse[modifier | modifier le code]
Elle est synthétisée par les hépatocytes et sécrétée dans le sang.
Variations génétiques[modifier | modifier le code]
Plus d'une centaine de variants génétiques du gène GC sont connus, avec des affinités variables avec la vitamine S[11]. Cela explique des différences de concentration de 25-hydroxyvitamine D circulante[12]. Ils ont été proposés pour expliquer certaines différences dans la concentration en vitamine D chez les différents groupes populationnels[13] et une corrélation a été mise en évidence entre la présence de ces variants et la réponse à une supplémentation en vitamine D[14].
La délétion homozygote du gène entraîne un tableau de fragilité osseuse avec ostéopénie, un taux sanguin de vitamine D effondrée, résistante à la supplémentation[15].
Références[modifier | modifier le code]
- GRCh38: Ensembl release 89: ENSG00000145321 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000035540 - Ensembl, May 2017
- « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- (en) « Possible localization of Gc-System on chromosome 4. Loss of long arm 4 material associated with father-child incompatibility within the Gc-System », Human Heredity, vol. 27, no 2, , p. 105–7 (PMID 558959, DOI 10.1159/000152857)
- (en) « Entrez Gene: GC group-specific component (vitamin D binding protein) »
- (en) « A structural basis for the unique binding features of the human vitamin D-binding protein », Nature Structural Biology, vol. 9, no 2, , p. 131–6 (PMID 11799400, DOI 10.1038/nsb754)
- (en) « GC - Vitamin D-binding protein precursor - Homo sapiens (Human) - GC gene & protein », sur www.uniprot.org (consulté le )
- (en) « From vitamin D to hormone D: fundamentals of the vitamin D endocrine system essential for good health », The American Journal of Clinical Nutrition, vol. 88, no 2, , p. 491S-499S (PMID 18689389)
- Chun RF, New perspectives on the vitamin D binding protein, Cell Biochem Funct, 2012;30:445-456
- Arnaud J, Constans J, Affinity differences for vitamin D metabolites associated with the genetic isoforms of the human serum carrier protein (DBP), Hum Genet, 1993;92:183-188
- (en) « A systematic review of the association between common single nucleotide polymorphisms and 25-hydroxyvitamin D concentrations », The Journal of Steroid Biochemistry and Molecular Biology, vol. 121, nos 1–2, , p. 471–7 (PMID 20363324, DOI 10.1016/j.jsbmb.2010.03.073)
- (en) « Vitamin D-binding protein and vitamin D status of black Americans and white Americans », The New England Journal of Medicine, vol. 369, no 21, , p. 1991–2000 (PMID 24256378, PMCID 4030388, DOI 10.1056/NEJMoa1306357)
- (en) « Common variants of the vitamin D binding protein gene and adverse health outcomes », Critical Reviews in Clinical Laboratory Sciences, vol. 50, no 1, january–february 2013, p. 1–22 (PMID 23427793, PMCID 3613945, DOI 10.3109/10408363.2012.750262)
- Henderson CM, Fink SL, Bassyouni H et al. Vitamin D–binding protein deficiency and homozygous deletion of the GC gene, N Engl J Med, 2019;380:1150-1157