Bicarbonate
| Bicarbonate | |
 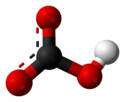 Structure de l'ion bicarbonate. |
|
| Identification | |
|---|---|
| Nom UICPA | hydrogénocarbonate |
| No CAS | |
| PubChem | 769 |
| ChEBI | 17544 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | HCO3 |
| Masse molaire[1] | 61,016 8 ± 0,001 8 g/mol C 19,68 %, H 1,65 %, O 78,66 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le bicarbonate, ou hydrogénocarbonate, est un ion polyatomique dont la formule chimique est HCO3−. Le bicarbonate doit son préfixe (« bi- ») à son double caractère acido-basique (dit caractère amphotère) : il est à la fois acide et base, appartenant à deux couples acido-basiques différents. Il s'agit de la forme intermédiaire dans la double déprotonation de l'acide carbonique : ôter le premier proton (ion H+) de l'acide carbonique donne le bicarbonate ; ôter le second proton donnera la forme carbonate ionique.
Le mot s'écrit au pluriel (bicarbonates) lorsqu'il s'agit des sels de l'ion bicarbonate : par exemple, le bicarbonate de sodium (souvent appelé « bicarbonate de soude » par abus de langage, ou « soda à pâte » et « petite vache » au Canada) de formule NaHCO3, qui est le sel de l'ion bicarbonate le plus répandu et le plus utilisé. Il contribue à la digestion par notre organisme.
Propriétés
[modifier | modifier le code]Dans l'eau, le dioxyde de carbone, l'acide carbonique, l'ion bicarbonate et l'ion carbonate sont en équilibre, en fonction du pH :
L'ajout d'un acide déplace les équilibres vers la gauche (avec, éventuellement, dégagement de dioxyde de carbone), tandis que l'ajout d'une base les déplace vers la droite (avec, éventuellement, précipitation d'un sel carbonaté).
Applications
[modifier | modifier le code]La transformation partielle des bicarbonates en contact avec des acides (tels l'acide acétique du vinaigre) en dioxyde de carbone gazeux est employée en cuisson pour permettre au pain de lever, et lors de la propulsion des fusées jouets.
Biologie humaine
[modifier | modifier le code]Norme
[modifier | modifier le code]La concentration en bicarbonate dans le sang est entre 22 et 26 mmol/L[2].
Solution tampon
[modifier | modifier le code]Le caractère amphotère du bicarbonate (sa place intermédiaire dans l'équilibre), lui fait jouer un rôle de tampon. Cette fonction de tampon des bicarbonates existe notamment dans le sang, avec un rôle très important pour le maintien du pH (cf. Homéostasie).
De nombreux organes interviennent dans la régulation du taux des bicarbonates, donc du pH : principalement les poumons (par l'intermédiaire de l'élimination du dioxyde de carbone) et les reins. Le système digestif intervient également, par la sécrétion du suc gastrique acide (sous le contrôle de la sécrétine) et des sels biliaires fabriqués par le foie et sécrétés dans la bile.
Activation des enzymes digestives
[modifier | modifier le code]La fonction exocrine du pancréas produit, par l'intermédiaire d'anhydrases carboniques, des ions bicarbonate HCO3− qui sont déversés dans le duodénum pour neutraliser l'acidité du chyme et ainsi activer les enzymes intestinales et les enzymes pancréatiques produites par cette même fonction exocrine.
Autres fonctions
[modifier | modifier le code]Le bicarbonate sert à la synthèse de l'uracile monophosphate (UMP), précurseur des bases pyrimidiques de l'ADN.
Il intervient aussi dans la capacitation des spermatozoïdes, durant la fécondation.
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Webmestre Cuen, « Chapitre complet. Désordres de l'équilibre acide-base - [nephrologie manuel n°7] », sur cuen.fr (consulté le ).
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Acide carbonique, dioxyde de carbone
- Carbonate
- Bicarbonate d'ammonium
- Bicarbonate de calcium
- Bicarbonate de lithium
- Bicarbonate de potassium
- Bicarbonate de sodium
Liens externes
[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :

