Trypsine
| Trypsine | ||
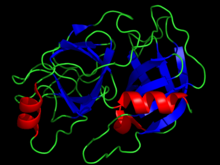
 Trypsine humaine (PDB 4WWY) avec la triade catalytique mise en évidence : l'aspartate 102 est en mauve, l'histidine 57 en cyan et la sérine 195 en rouge. | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Protéase à sérine | |
| Symbole | PRSS | |
| Synonymes | TRY | |
| N° EC | 3.4.21.4 | |
| Code ATC | B06 | |
| Gène PRSS1 – Trysine 1 | ||
| Homo sapiens | ||
| Locus | 7q34 | |
| Masse moléculaire | 26 558 Da[1] | |
| Nombre de résidus | 247 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène PRSS2 – Trypsine 2 | ||
| Homo sapiens | ||
| Locus | 7q34 | |
| Masse moléculaire | 26 488 Da[1] | |
| Nombre de résidus | 247 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène PRSS3 – Mésotrypsine | ||
| Homo sapiens | ||
| Locus | 9p13.3 | |
| Masse moléculaire | 32 529 Da[1] | |
| Nombre de résidus | 304 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
La trypsine (EC ) est une peptidase du suc pancréatique participant à la digestion des protéines. Il s'agit d'une protéase à sérine qui hydrolyse les liaisons peptidiques situées côté C d'un résidu de lysine ou d'arginine, qui sont des acides aminés basiques.
| Pfam | PF00089 |
|---|---|
| InterPro | IPR001254 |
| SMART | SM00020 |
| PROSITE | PDOC00124 |
| MEROPS | S1 |
| SCOP | 1c2g |
| SUPERFAMILY | 1c2g |
| CDD | cd00190 |
Synthèse[modifier | modifier le code]
Elle est synthétisée par le pancréas sous forme de trypsinogène (proenzyme inactive), puis stockée dans les vésicules enzymatiques des cellules acineuses d'où elle est excrétée au moment de la digestion. L'activation du trypsinogène en trypsine est le résultat de l'hydrolyse du propeptide sous l'action de l'entérokinase ou par un effet d'autoactivation de la trypsine. La cholecystokinine-pancréozymine active la sécrétion des enzymes (donc de la trypsine) dans le suc pancréatique.
Activité enzymatique[modifier | modifier le code]
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
La trypsine est une endoprotéase qui hydrolyse les liaisons peptidiques dans lesquelles un acide aminé basique (Lys-|-Xaa ou Arg-|-Xaa) engage sa fonction acide (sauf dans le cas où l'acide aminé suivant (schématisé ici par "Xaa") est une Proline). Elle coupe en C-terminal de ces acides aminés. En d'autres termes, elle transforme les chaînes polypeptides en chaînes protéiques plus courtes pour permettre la digestion. Efficace à pH 7,5 - 8,5, elle est inactivée et digérée en quelques heures à pH neutre (=7) dans l'intestin.
La trypsine participe à l'activation d'autres enzymes comme l'alpha-chymotrypsine par coupure hydrolytique de la chaîne polypeptidique du chymotrypsinogène.
Cette enzyme sous sa forme S-trypsine ou trysine-like sert également lors de la 1re semaine du développement embryonnaire humain, la segmentation. Elle est sécrétée par le trophoblaste afin de digérer la zone pellucide entourant le blastocyste. Ce phénomène s'appelle l'éclosion qui a lieu aux alentours de J6, qui permet l'implantation dans l'endomètre.
Mécanisme[modifier | modifier le code]
La trypsine appartient à la famille des protéases à sérine dont elle est l'archétype. Ces enzymes sont caractérisées par la présence d'une triade catalytique composée des chaînes latérales de trois acides aminés : une sérine (Ser-195), une histidine (His-57) et un aspartate (Asp-102). Ces résidus sont en interaction et forment un relai de charge qui rend nucléophile la serine du site actif et permet l'attaque du groupement carbonyle de la liaison peptidique hydrolysée.

De plus, la trypsine contient un « trou oxyanion » bordé par les groupements amides du squelette polypeptidique au niveau de la glycine 193 et de la serine 195. Cette cavité accueille l'atome d'oxygène du groupement carbonyle de la liaison peptique clivée et stabilise l'intermédiaire de réaction en favorisant la formation d'une charge négative sur l'oxygène.
La reconnaissance d'un résidu chargé positivement juste en amont du site de coupure est réalisée par le groupement carboxylate (-COO−) de l'aspartate 189 qui est situé au fond de la poche de reconnaissance de la chaîne latérale de l'acide aminé situé juste en amont (côté N-terminal) du site de clivage. L'interaction électrostatique entre la charge positive de l'acide aminé reconnu et la charge négative de l'aspartate est le facteur principal de cette sélectivité.

Pathologies associées[modifier | modifier le code]
Dans la pancréatite et la mucoviscidose, la trypsine étant mal évacuée, elle est la principale cause de la réaction inflammatoire du pancréas.
Utilisation[modifier | modifier le code]
La trypsine se retrouve chez la plupart des animaux. Cette enzyme est très utilisée pour des approches de recherche en protéomique, spécialement pour la caractérisation et séquençage de protéines. Elle est ainsi notamment utilisée en spectrométrie de masse pour digérer les protéines avant analyse.
La trypsine est utilisée en culture cellulaire pour détacher des cellules adhérant sur les flasques de culture ou les boîtes de Petri. En effet, la trypsine clive les protéines membranaires d'adhésion, et les cellules se retrouvent alors en suspension. Cette "trypsinisation" est quotidiennement utilisée pour maintenir les cultures cellulaires (en passant à une flasque de culture plus grande ou en multipliant les flasques), pour compter les cellules par cytométrie en flux, ou pour faire d'autres analyses. Ce traitement affecte cependant un peu les cellules (viabilité, marqueurs membranaires), aussi l'action de la trypsine doit-elle être limitée: éliminée par lavage des cellules, elle est aussi inhibée par un ajout de sérum de veau fœtal (protéines en large excès sur les protéines membranaires), ou d'un inhibiteur spécifique[2]. Alternativement, d'autres enzymes sont utilisées[3].
La trypsine est également utilisée en immuno-hématologie pour la recherche des anticorps irréguliers ou encore lors de l'établissement d'un caryotype : par exemple, en hydrolysant les histones, et combinée à la coloration par le Giemsa, elle permet l'apparition de bandes G sur l'ADN et donc l'identification précise des chromosomes. Une anomalie chromosomique peut être ainsi détectée.
Séquence de la trypsine humaine[modifier | modifier le code]
L'isoforme A contient 304 acides aminés.
10 20 30 40 50 60 70 80 90 100
MCGPDDRCPA RWPGPGRAVK CGKGLAAARP GRVERGGAQR GGAGLELHPL LGGRTWRAAR DADGCEALGT VAVPFDDDDK IVGGYTCEEN SLPYQVSLNS
110 120 130 140 150 160 170 180 190 200
GSHFCGGSLI SEQWVVSAAH CYKTRIQVRL GEHNIKVLEG NEQFINAAKI IRHPKYNRDT LDNDIMLIKL SSPAVINARV STISLPTTPP AAGTECLISG
210 220 230 240 250 260 270 280 290 300
WGNTLSFGAD YPDELKCLDA PVLTQAECKA SYPGKITNSM FCVGFLEGGK DSCQRDSGGP VVCNGQLQGV VSWGHGCAWK NRPGVYTKVY NYVDWIKDTI AANS
L'isoforme B contient 260 acides aminés.
10 20 30 40 50 60 70 80 90 100
MELHPLLGGR TWRAARDADG CEALGTVAVP FDDDDKIVGG YTCEENSLPY QVSLNSGSHF CGGSLISEQW VVSAAHCYKT RIQVRLGEHN IKVLEGNEQF
110 120 130 140 150 160 170 180 190 200
INAAKIIRHP KYNRDTLDND IMLIKLSSPA VINARVSTIS LPTTPPAAGT ECLISGWGNT LSFGADYPDE LKCLDAPVLT QAECKASYPG KITNSMFCVG
210 220 230 240 250 260
FLEGGKDSCQ RDSGGPVVCN GQLQGVVSWG HGCAWKNRPG VYTKVYNYVD WIKDTIAANS
L'isoforme C contient 247 acides aminés.
10 20 30 40 50 60 70 80 90 100
MNPFLILAFV GAAVAVPFDD DDKIVGGYTC EENSLPYQVS LNSGSHFCGG SLISEQWVVS AAHCYKTRIQ VRLGEHNIKV LEGNEQFINA AKIIRHPKYN
110 120 130 140 150 160 170 180 190 200
RDTLDNDIML IKLSSPAVIN ARVSTISLPT TPPAAGTECL ISGWGNTLSF GADYPDELKC LDAPVLTQAE CKASYPGKIT NSMFCVGFLE GGKDSCQRDS
210 220 230 240
GGPVVCNGQL QGVVSWGHGC AWKNRPGVYT KVYNYVDWIK DTIAANS
Notes et références[modifier | modifier le code]
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- http://www.interchim.fr/ft/1/158624.pdf Inhibiteurs de la trypsine (SBTI, BPTI, SPTI)
- http://www.interchim.fr/ft/N/N68081.pdf Dissociation douce des cellules par l'Accutase
Voir aussi[modifier | modifier le code]
- La chymotrypsine et la carboxypeptidase A, deux protéases pancréatiques activées par la trypsine.