Kératocône
| Spécialité | Ophtalmologie et optométrie |
|---|
| CISP-2 | F99 |
|---|---|
| CIM-10 | H18.6 |
| CIM-9 | 371.6 |
| OMIM | 148300 |
| DiseasesDB | 7158 |
| MedlinePlus | 001013 |
| eMedicine | 1194693 |
| MeSH | D007640 |
Le kératocône (du grec kerato, « corne », « cornée » et konos, « cône ») est une maladie dégénérative de l'œil qui se traduit par une perte de la sphéricité de la cornée qui prend alors la forme d'un cône.
Le kératocône peut causer des distorsions substantielles de la vision, conduisant à des images multiples, des stries et une hyper-sensibilité à la lumière. Le kératocône est la plus commune des dystrophies de la cornée. Cette maladie affecte moins d'une personne sur deux mille (reconnue comme étant une maladie rare) et semble toucher toutes les catégories de population dans le monde, bien que sa prévalence soit plus prononcée chez les Asiatiques.
La maladie est typiquement diagnostiquée durant l'adolescence du patient et atteint son stade le plus avancé vers 20-30 ans.
Le kératocône est une maladie peu connue et dont les causes sont incertaines. Sa progression après le diagnostic reste imprévisible et relativement lente. Si elle touche les deux yeux, la détérioration de la vision peut affecter la capacité du patient à conduire une voiture ou à lire normalement. Dans la plupart des cas, les verres correcteurs (ou par des verres de contact) sont assez efficaces pour permettre au patient de continuer à conduire légalement et à retrouver une activité normale. Une progression plus importante de la maladie peut mener à une intervention chirurgicale comprenant notamment les greffes cornéennes. En dépit de ces incertitudes, le kératocône peut être contrôlé avec succès avec une variété de techniques médicales ou chirurgicales, souvent avec peu ou pas d'affaiblissement de la qualité de vie du patient.
Historique[modifier | modifier le code]

C'est dans une dissertation doctorale de 1748 que l'oculiste allemand Burchard Mauchard fournit la plus ancienne description du kératocône qu'il appelle staphyloma diaphanum. Cependant, une description claire de cette maladie n'est donnée qu'en 1854 lorsque le Britannique John Nottingham en fait la distinction parmi d'autres anévrismes de la cornée[1]. Nottingham rapporte les cas de « cornée sphérique » qui ont retenu son attention et décrit plusieurs caractéristiques classiques de la maladie telles que la vision double (diplopie), la faiblesse de la cornée, et la difficulté de conserver des verres correcteurs pour la vision du patient. En 1859, le chirurgien britannique William Bowman utilise un ophtalmoscope (inventé par le physicien allemand Hermann von Helmholtz) pour diagnostiquer le kératocône, et décrit comment incliner le miroir de l'instrument de manière à mieux distinguer la forme conique de la cornée[2]. Bowman essaie également de restaurer la vision en tirant sur l'iris à l'aide d'un fin crochet inséré à travers la cornée et en étirant la pupille selon une fente sténopéique verticale (forme que l'on peut observer chez le chat, par exemple). Il rapporte qu'il a obtenu un succès avec cette technique en restaurant la vision d'une femme de 18 ans, jusque-là incapable de compter sur ses doigts à une distance de 20 cm. En 1869, lorsque le pionnier suisse de l'ophtalmologie Johann Horner rédige une thèse intitulée sur le traitement du kératocône[3], la maladie a déjà acquis sa dénomination actuelle. Le traitement à cette époque, approuvé par le principal ophtalmologue allemand Albrecht von Gräfe, est une tentative pour reformer physiquement la cornée par cautérisation chimique via une solution de nitrate d'argent et l'application d'un agent amenant à la contraction de la pupille (myosis) par l'application d'une pression. En 1888, le traitement du kératocône devient l'une des premières applications pratiques des verres de contact récemment mis au point par le physicien français Eugène Kalt qui fabrique une coquille de verre améliorant la vision en comprimant la cornée en une forme plus régulière[4].
Depuis le début du XXe siècle la recherche sur le kératocône a amélioré la compréhension de la maladie et considérablement augmenté la gamme des options de traitement.
Causes et mécanismes[modifier | modifier le code]
En dépit de la recherche, les causes du kératocône restent encore un mystère. Selon la United States National Keratoconus Foundation[5], il est probable que cette atteinte puisse résulter d'une combinaison de multiples facteurs : génétiques, environnementaux ou cellulaires, chacun de ceux-ci pouvant entraîner le déclenchement de la maladie. Une fois contractée, la maladie se développe par la dissolution progressive de la couche de Bowman, la membrane se trouvant entre l'épithélium de la cornée et le stroma, constituant normalement l'essentiel de l'épaisseur de cet organe. Lorsque ces deux dernières entrent en contact, les changements structuraux et cellulaires de la cornée compromettent son intégrité et mènent à l'enflement caractéristique de la maladie. Dans toute cornée kératocônique, on peut déceler des régions d'amincissement dégénératif qui coexistent avec des régions subissant la blessure curative.
Une prédisposition génétique au kératocône a été observée[6], avec, dans certaines familles, une transmission héréditaire de la maladie[7],[8] ou alors des concordances de cas chez de vrais jumeaux. La probabilité d'être atteint lorsqu'un membre de sa famille l'est n'est pas encore clairement quantifiée, ce nombre étant entre 6 et 19 %[9]. Le gène responsable n'a pas encore été identifié : deux études impliquant des communautés isolées et largement homogénétiques ont donné des résultats contradictoires localisant le gène au niveau des chromosomes 16q et 20q[9]. Toutefois, la plupart des études génétiques s'accordent sur le modèle d'une transmission autosomique dominante. Le kératocône est également diagnostiqué plus fréquemment chez les personnes ayant un syndrome de Down ou trisomie 21, bien que les raisons de ce lien n'aient pas encore été clairement définies[10]. Le kératocône a été associé avec certaines maladies allergiques, incluant l'asthme et l'eczéma. Un certain nombre d'études suggèrent que le frottage vigoureux de l'œil puisse contribuer à la progression du kératocône, et que cette pratique devrait être fortement déconseillée chez ces patients[11],[12],[13],[14],[15].
La déformation visuelle éprouvée par le patient a deux explications, l'une étant la déformation irrégulière de la surface de la cornée, l'autre les cicatrices qui se produisent sur les régions les plus exposées. Ces facteurs amènent à la formation de régions sur la cornée qui peuvent former une image à différents endroits sur la rétine causant le symptôme de polyopie monoculaire. L'effet peut empirer dans des conditions de faible luminosité où la pupille, adaptée à l'obscurité, se dilate : elle expose ainsi la rétine et plus particulièrement la macula à une plus grande surface irrégulière de la cornée. Le marquage semble être un aspect de la dégradation cornéenne. Cependant, une étude suggère que l'abrasion par des verres de contact puisse augmenter cette probabilité d'un facteur deux ou plus[16]. Un certain nombre d'études ont indiqué que les cornées kératocôniques montrent des signes d'activité métabolique accrue via les protéases, une classe d'enzymes qui dégradent une partie du collagène présent dans le stroma de la cornée, avec simultanément une réduction de l'expression du gène de l'enzyme inhibiteur de la protéase[17]. D'autres études ont suggéré que l'activité réduite de l'enzyme aldéhydedéshydrogénase peut être responsable d'une production de radicaux libres et d'espèces oxydantes dans la cornée[18]. Il semble probable, en plus du pathogénétique, que les dommages provoqués dans la cornée résultent en une réduction de son épaisseur et de sa force biomécanique.
Épidémiologie[modifier | modifier le code]

Le National Eye Institute rapporte que le kératocône est la plus commune des dystrophies cornéennes aux États-Unis, affectant approximativement un américain sur 2000[19],[20] mais certains rapports mentionnent une proportion de 1 pour 500[21]. Cette incohérence peut être due aux variations dans les critères de diagnostic, qui dans certains cas interprètent un astigmatisme sévère comme un kératocône, et vice versa[22]. Une étude à long terme a montré une incidence annuelle de 2 cas pour 100 000 habitants[20]. Les hommes, les femmes, ainsi que toutes les ethnies y seraient exposés dans les mêmes proportions bien que certaines études récentes émettent quelques doutes à ce propos, suggérant une plus grande prévalence chez les femmes[23]. Cependant son ampleur est variable selon la littérature consultée. Une étude anglaise a également suggéré que les personnes d'origine asiatique auraient 4,4 fois plus de risques de souffrir du kératocône que les gens de type caucasien, et seraient aussi affectés plus tôt[24].
Le kératocône est habituellement bilatéral[20] (affectant les deux yeux) bien que la distorsion est souvent différente pour les deux cornées. Les cas unilatéraux sont plus rares, mais peuvent être sous-estimés si la vision modérée dans le meilleur des deux yeux est simplement au-dessous de la limite de la détection clinique[22]. Il est commun que le kératocône soit diagnostiqué d'abord dans un œil et pas avant un certain temps dans l'autre. Comme la maladie progresse dans les deux yeux, la vision dans l'œil « tôt-diagnostiqué » restera souvent plus altérée que celle de l'œil controlatéral.
Caractéristiques[modifier | modifier le code]
Symptômes[modifier | modifier le code]

« ... une bougie, quand on la regarde, apparaît comme un ensemble de sources lumineuses, allant de manière confuse de l'une à l'autre » — Nottingham[1].
Les personnes ayant un kératocône notent typiquement un flou mineur de leur vision et viennent chez leur médecin dans le but d'obtenir des verres correctifs pour la lecture ou la conduite. Aux premiers signes, ces symptômes peuvent ne pas être différenciables de ceux de n'importe quel autre défaut réfringent de l'œil. Lorsque la maladie progresse, la vision se détériore, parfois très rapidement. L'acuité visuelle devient alors altérée à toutes les distances, et la vision de nuit est souvent réduite. Quelques individus ont une vision plus altérée sur un œil que sur l'autre. Certains développent une photophobie (hypersensibilité à la lumière), une contrainte de loucher pour lire, ou des démangeaisons oculaires. Il n'y a habituellement peu ou pas de sensation de douleur. Le symptôme classique du kératocône est la perception d'images fantômes multiples connue sous le nom de « polyopie monoculaire ». Cet effet est plus clairement observé dans un champ de contraste élevé, tel qu'un point de lumière sur un fond foncé : au lieu de voir juste un point, une personne avec le kératocône voit de nombreuses images du point, disposées de manière chaotique. Typiquement, la disposition des images ne change pas de jour en jour, mais avec le temps elle prend souvent de nouvelles formes. Généralement les patients notent aussi la présence de stries déformées autour des sources lumineuses. Parfois certains patients notent également que les images se déplacent de manière relative l'une vers l'autre au rythme des battements de leur cœur.
Signes et diagnostic[modifier | modifier le code]
Avant tout autre examen physique, le diagnostic du kératocône commence fréquemment par une évaluation ophtalmologique des antécédents médicaux du patient (antécédent d'une maladie ou de dommages oculaires qui pourraient affecter la vision, et la présence d'antécédents familiaux d'une maladie oculaire). Il se poursuit par l'évaluation de la plainte principale et des autres symptômes visuels.
Un examen de l'œil, tel qu'un test de Snellen standard (lecture de lettres de plus en plus petites), est alors employé pour déterminer l'acuité visuelle. L'examen oculaire peut être complété d'une mesure de la courbure localisée de la cornée à l'aide d'un kératomètre manuel (instrument mesurant la courbure extérieure de la cornée)[25], la détection d'un astigmatisme irrégulier suggérant une possibilité de kératocône. Les cas graves peuvent excéder les capacités de mesure de l'instrument. Une autre indication peut être fournie par une rétinoscopie (mesure de l'état de réfraction de l'œil) au cours de laquelle une fente lumineuse est projetée sur la rétine du patient. La lumière réfléchie par l'œil du patient provoque des reflets observés par le praticien. Le kératocône fait partie des pathologies ophtalmologiques présentant un « reflet en ciseaux » : le reflet lumineux, au lieu d'être homogène, a un centre sombre qui le divise en deux branches[26]. Si le kératocône est suspecté, l'ophtalmologue recherchera d'autres traits caractéristiques de la maladie au moyen d'un examen de la cornée. Un cas avancé est habituellement tout à fait évident à l'examinateur, et celui-ci peut prévoir un diagnostic non ambigu avant un examen plus spécialisé. Lors d'un examen plus approfondi, on peut observer un anneau de pigmentation de couleur vert-olive à jaune-brun connue sous le nom d'anneau de Fleischer, autour des yeux kératocôniques[27].
L'anneau de Fleischer, causé par le dépôt de fer sur l'épithélium de la cornée, est subtil et peut ne pas toujours être détecté dans tous les cas mais il devient plus évident lorsqu'il est analysé sous un filtre bleu-cobalt. De manière similaire, 50 % des patients présentent des « stries de Vogt », c'est-à-dire des fines lignes sur la cornée causées par son étirement et son amincissement[27]. Les stries disparaissent temporairement lorsqu'une légère pression est appliquée au globe oculaire. Un cône très prononcé peut créer un motif en forme de V dans la paupière inférieure lorsque le regard est dirigé vers le bas, appelé « signe de Munson ». Les autres signes cliniques du kératocône sont normalement déjà présents bien avant que le signe de Munson devienne évident[22]. C'est pourquoi, bien qu'étant un signe classique de la maladie, il tend à ne pas être de première importance dans la démarche diagnostique.
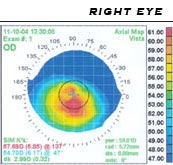
Un kératoscope manuel, aussi appelé « disque de Placido », peut permettre une visualisation simple et non-invasive de la surface de la cornée en projetant une série de cercles lumineux concentriques sur celle-ci. Un diagnostic plus définitif peut être obtenu par le biais d'une topographie cornéenne, au cours de laquelle un instrument automatique projette un modèle lumineux sur la cornée et détermine sa topologie à partir de l'analyse de l'image numérique. La carte topographique indique toutes les déformations de la cornée, le kératocône se marquant par une augmentation caractéristique de la courbure qui se situe habituellement au-dessous de la ligne centrale de l'œil. La technique peut enregistrer un instantané du degré et de l'ampleur de la déformation qui peut être utilisé comme repère afin d'évaluer son taux de progression. Elle est de première importance car elle permet de détecter la maladie à ses premiers stades alors que les autres symptômes ne sont pas encore évidents[28].
Une fois le kératocône détecté, son degré d'importance peut être défini par plusieurs mesures[29],[30] :
- l'inclinaison de la courbure la plus prononcée qui peut être : moyenne (< 45 dioptries), avancée (jusqu'à 52 D) ou sévère (> 52 D) ;
- la morphologie du cône : mamelon (petit : 5 mm et près du centre), ovale (large, au-dessous du centre et souvent fléchissant) ou glôbe (plus de 75 % de la cornée affectée) ;
- la finesse de la cornée pouvant aller de moyenne (> 506 µm) à avancée (< 446 µm).
L'utilisation de ces termes tend cependant à décliner par suite de l'utilisation croissante de la topographie cornéenne[30].
Évolution[modifier | modifier le code]
Typiquement, les patients atteints du kératocône présentent un astigmatisme léger, découvert généralement au début de la puberté, et sont diagnostiqués comme ayant la maladie à la fin de leur adolescence ou à l'âge adulte. Un diagnostic de la maladie à un très jeune âge peut indiquer un plus grand risque de sévérité à l'âge adulte[31].
La vision du patient peut fluctuer pendant une période de quelques mois, le conduisant à des changements fréquents dans les prescriptions de lentilles mais la situation empirant, les verres de contact deviennent obligatoires dans la majorité des cas. Le cours de la maladie est cependant variable : elle peut rester stable chez certains patients pendant des années voire indéfiniment, alors que pour d'autres elle peut progresser très rapidement. Le plus généralement, le kératocône progresse sur une période de 10 à 20 ans[22] avant la stabilisation de la maladie.

Pour les cas les plus avancés, le gonflement de la cornée peut avoir comme conséquence une rupture localisée de la membrane de Descemet, une couche intérieure de la cornée. L'humeur aqueuse de la chambre antérieure de l'œil s'infiltre alors dans la cornée avant que la membrane de Descemet ne se rescelle. La survenue de douleurs oculaires et la baisse soudaine de la vision, la cornée prenant un aspect blanc-laiteux translucide, sont connues sous le nom de corneal hydrops[32].
Bien qu'invalidant pour le patient, les signes sont habituellement provisoires et après une période de 6 à 8 semaines la cornée retrouve sa transparence d'origine. Le rétablissement peut être facilité de manière non chirurgicale par un bandage avec une solution saline osmotique. Bien que les hydrops causent habituellement le plus grand marquage de la cornée, elles permettent parfois au patient de bénéficier d'un cône plus plat, facilitant l'ajustage des verres de contact[32]. Très occasionnellement, et dans des cas extrêmes, la cornée s'amincit au point qu'une rupture partielle se produit, avec pour résultat un petit gonflement rempli de fluide semblable à une perle visible sur la cornée. Quand cela se produit, la greffe cornéenne peut devenir nécessaire voire urgente pour éviter une rupture complète pouvant mener à une perte de l'œil[32].
Diagnostic différentiel[modifier | modifier le code]
D'autres maladies oculaires non-inflammatoires, généralement plus rares que le kératocône, peuvent également causer un amincissement de la cornée[22].
Kératoglobe[modifier | modifier le code]
Le kératoglobe, également appelé phylome pellucide globuleux, est une ectasie cornéenne non inflammatoire rare, congénitale, caractérisée par un amincissement cornéen diffus. Les descriptions les plus anciennes l'associaient au glaucome congénital, à la mégalocornée, ou à une forme extrême de kératocône. Cette dernière hypothèse est étayée par l'existence de plusieurs cas de transformation de kératocône en kératoglobe et de familles où les pathologies coexistent.
Dégénérescence pellucide marginale[modifier | modifier le code]
La dégénérescence pellucide marginale cause un amincissement sur une bande étroite de 1 à 2 mm de large, cette zone étant elle-même séparée du limbe par une zone de cornée normale de 1 à 2 mm de large. Elle peut causer un astigmatisme important et souvent irrégulier qui peut dans la plupart des cas être corrigé par le port de lunettes.
Kératocône postérieur[modifier | modifier le code]
En dépit de leur nom similaire, le kératocône et le kératocône postérieur sont deux maladies distinctes. Le kératocône postérieur est une anomalie rare, souvent de naissance, qui cause un amincissement non progressif de la surface postérieure de la cornée. Le kératocône postérieur affecte généralement un seul œil.
Traitements[modifier | modifier le code]
Lentilles[modifier | modifier le code]
Aux premières étapes du kératocône, les verres correcteurs peuvent suffire pour corriger un astigmatisme modéré. Cependant, la maladie peut progresser et les verres peuvent ne plus fournir au patient un degré satisfaisant d'acuité visuelle, et la plupart des ophtalmologistes se tourneront alors vers les lentilles médicales.

Pour les patients kératoconiques, les verres de contact améliorent la vision au moyen de liquide lacrymal pour remplir les lacunes entre la surface cornéenne irrégulière et la surface intérieure régulière douce de la lentille, créant l'effet d'une cornée plus lisse. De nombreux types de verres de contact spécialisés ont été développés pour le kératocône, et les personnes atteintes peuvent trouver à la fois des médecins spécialistes des affections de la cornée, et des assembleurs de verres de contact qui ont l'expérience du traitement de patients kératoconiens. Le cône irrégulier présente un défi et l'assembleur essayera de produire une lentille avec le contact, la stabilité et l'inclinaison optimaux. Un certain ajustage de précision par essais-erreurs peut s'avérer nécessaire[22].
Traditionnellement, les verres de contact pour le kératocône sont les variétés dites dures, la lentille étant rigide mais restant perméable aux gaz, bien que les fabricants aient également produit une variété souple ; ou lentilles hydrophiles. Une lentille souple a tendance à se conformer à la forme conique de la cornée, diminuant de ce fait son efficacité. Pour lutter contre cela, des lentilles hybrides ont été développées qui sont, à la fois, dures en leur centre et molles en leur périphérie. Les lentilles souples ou hybrides ne sont cependant pas efficaces pour chaque patient[33].
Quelques patients trouvent également une bonne correction de vision et un confort avec une combinaison dite piggyback, dans laquelle des lentilles rigides sont portées au-dessus de lentilles souples, toutes les deux fournissant un degré de correction de la vision[34]. La lentille piggyback se sert d'une lentille souple avec une zone centrale fraisée pour accepter la lentille rigide. Le raccord d'une combinaison de lentille piggyback exige une certaine expérience de la part de l'assembleur de cette dernière, et une tolérance de la part du patient kératoconique. Des lentilles sclérales sont parfois prescrites pour des cas de kératocône avancé ou très irrégulier, ces lentilles couvrant une plus grande surface de l'œil et par conséquent pouvant offrir une meilleure stabilité[35]. La grande taille des lentilles peut les rendre désagréables ou inconfortables chez certains patients. Toutefois leur manipulation plus facile peut permettre d'avoir les faveurs de patients présentant une dextérité plus réduite, telles les personnes âgées.
Options chirurgicales[modifier | modifier le code]
Transplantation de la cornée[modifier | modifier le code]

Environ 10 % à 25 % des cas de kératocône[5],[36],[37] évoluent à un point où la correction de la vision par lentilles n'est plus satisfaisante, la finesse de la cornée devenant trop excessive ou bien un marquage de la cornée en raison de l'usage du verre de contact pouvant lui-même poser des problèmes. Une transplantation de la cornée ou « kératoplastie transfixiante » (ou pénétrante) est alors requise. Le kératocône est l'une des causes les plus communes conduisant à une kératoplastie, représentant généralement un quart de telles procédures[38].
Le chirurgien trépanne un lenticule du tissu cornéen du receveur, puis positionne à ce niveau le greffon du donneur, employant habituellement une combinaison de sutures individuelles et courantes. La cornée n'a pas besoin d'un approvisionnement direct en sang, une compatibilité entre les groupes sanguins ou HLA n'est donc pas exigée, le problème de rejet ne se posant pas de manière courante, contrairement aux autres transplantations d'organes.
La période de rétablissement peut prendre de 4 à 6 semaines et la pleine stabilisation postopératoire de la vision prend souvent une année ou plus, mais la plupart des greffes sont très stables sur le long terme. La base nationale du kératocône signale que la kératoplastie pénétrante a le plus haut taux de réussite de toutes les procédures de greffe : dans le cas précis du kératocône son taux de succès peut être de 95 % ou plus[5]. Les sutures utilisées se dissolvent habituellement au-dessus d'une période de 3 à 5 ans mais les sutures individuelles peuvent être enlevées pendant le processus de cicatrisation si elles causent de l'irritation au patient. Aux États-Unis, les transplantions de cornée pour le traitement du kératocône sont habituellement effectuées sous simple sédation. Dans d'autres pays, tels que l'Australie ou le Royaume-Uni, l'opération est généralement effectuée sous anesthésie générale. Tous les cas requièrent le suivi d'un chirurgien ophtalmologue pendant un certain nombre d'années. Souvent, la vision est considérablement améliorée après la chirurgie, mais même si l'acuité visuelle n'est pas améliorée, les patients peuvent toutefois bénéficier plus facilement de verres correcteurs, la cornée ayant repris une forme plus normale après la fin de la cicatrisation. Des complications des greffes cornéennes sont la plupart du temps liées à la vascularisation du tissu cornéen car elle peut provoquer un rejet du greffon.
La perte de la vision est très rare, bien qu'une vision difficile à corriger soit possible. Lors d'un rejet, une seconde transplation est souvent tentée et est fréquemment réussie[39].
Le kératocône ne réapparait normalement pas dans la cornée transplantée. certains cas ont été observés mais sont généralement attribués à une excision incomplète de la cornée d'origine ou à un examen inadéquat du tissu du donneur[40]. Les perspectives à long terme pour les greffes cornéennes réalisées dans le cas de kératocône sont habituellement favorables une fois la cicatrisation faite et que plusieurs années se sont écoulées sans problème.
Transplantation DALK[modifier | modifier le code]
Une manière de réduire le risque de rejet est l'emploi d'une technique récente appelée Deep Anterior Lamellar Keratoplasty, abrégée par DALK. Dans ce type de greffe, seul l'épithélium extérieur et la partie principale de la cornée, le stroma, sont remplacés, la couche endothéliale du patient étant préservée, donnant une intégrité structurale additionnelle à la cornée post-greffée. Puisqu'un rejet de greffon commence habituellement dans l'endothélium, le risque de rejet s'en trouve considérablement réduit.
En outre, il est possible de transplanter un tissu qui a été lyophilisé, ce processus dévitalisant ainsi ce dernier, diminuant notablement le risque de rejet.
Quelques chirurgiens préfèrent enlever l'épithélium du donneur, d'autres laissent les cellules du donneur en place; les enlever peut causer une légère amélioration dans la vision globale, mais celle-ci va de pair avec une augmentation du temps de rétablissement de la vision.
Épikératoplastie[modifier | modifier le code]
Rarement, une kératoplastie non-pénétrante, appelée « épikératoplastie » peut être effectuée dans le cas d'un kératocône. L'épithélium cornéen du patient est enlevé et un lenticule de la cornée du donneur est greffé au-dessus. Le procédé est plus complexe et est moins fréquemment exécuté qu'une kératoplastie transfixiante car les résultats sont généralement moins favorables. L'épikératoplastie peut cependant être perçue comme option dans un certain nombre de cas, en particulier pour de jeunes patients[41].
L'utilisation des anneaux intracornéens[modifier | modifier le code]
Une alternative récente à la transplantation de la cornée est l'insertion d'anneaux intracornéens. Une petite incision est réalisée à la périphérie de la cornée et deux fins arcs de polyméthacrylate de méthyle sont glissés entre les couches du stroma cornéen des deux côtés de la pupille avant la fin de l'incision. Les segments exercent une pression contre la courbure de la cornée, aplatissant le pic du cône et ramenant la cornée à une forme plus naturelle. La méthode, réalisée sous anesthésie locale, offre le bénéfice de la réversibilité car elle n'implique aucune lésion définitive du tissu de l'œil.
Les deux principaux types d'anneaux intrastroma disponibles sont connus sous les appellations commerciales « INTACs » et « anneaux Ferrara ». Les INTACs sont plus plats et moins centralement placés que les anneaux prismatiques Ferrara. Les INTACs ont été approuvés pour la première fois en 1999 aux États-Unis par la Food and Drug Administration (FDA) dans le cas de la myopie. Leur utilisation a ensuite été étendue au traitement du kératocône en [42]. Les anneaux Ferrara attendent l'approbation de FDA pour le kératocône. Conceptuellement, la technique repose sur l'injection d'un gel synthétique transparent dans un canal alésé par le stroma. Lorsque le gel polymérise, il se raidit et prend les propriétés semblables à ceux des pré-anneaux formés[43].
Les études cliniques sur l'efficacité des anneaux intrastromaux pour le traitement du kératocône en sont à leurs premiers développements, et les résultats sont jusqu'ici plutôt encourageants[44],[45], bien qu'ils doivent encore obtenir l'accord de tous les chirurgiens ophtalmologues. Les anneaux offrent une bonne chance d'amélioration de la vision, mais les résultats ne sont pas garantis et dans quelques cas l'état peut même empirer.
En plus d'une kératoplastie transfixiante, l'utilisation de verres de contact hydrophiles ou de lunettes peut rester nécessaire pour une certaine correction de vision.
Les complications potentielles d'anneaux intracornéens incluent la pénétration accidentelle à travers la chambre antérieure de l'œil, les infections post-opératoires de la cornée, et la migration ou l'extrusion des anneaux[45].
Les premières études sur les anneaux cornéens intrastromaux impliquaient l'utilisation de deux segments pour l'aplatissement global de la cornée[46]. On a découvert plus récemment que de meilleurs résultats pouvaient être obtenus pour les cônes localisés à la périphérie de la cornée en utilisant un simple arc INTACs. Ce qui mène à l'aplatissement préférentiel du cône, mais également à augmenter la partie plate supérieure au-dessus de la cornée[47].
Kératotomie radiale[modifier | modifier le code]
La kératotomie radiale est une procédure chirurgicale, dite réfractive, où le chirurgien réalise une incision dans la cornée afin d'en modifier la forme. Cette ancienne option chirurgicale pour la myopie est largement remplacée par les méthodes Lasik (par utilisation d'un faisceau laser) et autres procédures similaires. La procédure LASIK est en elle-même contre-indiquée dans le cas des kératocônes et des amincissements cornéens car le déplacement du tissu stromal cornéen endommagera à terme une cornée déjà mince et fragile[48].
Pour des raisons similaires, la kératotomie radiale n'a généralement pas été utilisée sur des patients kératocôniques[49],[50]. Cependant, une clinique italienne a rapporté certains succès avec une procédure de kératotomie radiale asymétrique[51] au cours de laquelle les incisions sont confinées à un secteur de l'œil. La finesse de la cornée est d'abord mesurée via un pachymètre, le chirurgien réalisant ensuite une incision d'une profondeur de 70-80 % de l'épaisseur mesurée. Le patient subit initialement des tests de photophobie et de fluctuation de la vision, commune avec d'autres formes de chirurgie réfractive[51].
Réticulation du collagène cornéen avec la riboflavine (C3-R)[modifier | modifier le code]
Mise au point en 1997 à l'université de technologie de Dresde, la réticulation du collagène cornéen avec la riboflavine[17],[52], ou en:Corneal collagen cross-linking est pratiqué en France depuis 2006[53]. Il s'agit d'un traitement chirurgical où de la riboflavine, est activée sous une lumière ultraviolette pendant environ 30 minutes, dans le but d'augmenter la réticulation du collagène avec le stroma. Le collagène cornéen ainsi rigidifié n'exercerait plus les mêmes contraintes de tension de la cornée, on espère ainsi prévenir l’évolution du kératocône voire la faire reculer[53]. L'opération ne peut pas affranchir le patient de corrections visuelles, on peut cependant espérer limiter la détérioration de la vision, et réduire le recours à la greffe cornéenne.
Une étude parue en 2007 dans le Journal of cataract and refractive surgery montrerais une amélioration deux fois supérieure lorsque la procédure était combinée avec des anneaux intracornéens INTACs, par rapport à l'utilisation des INTACs seuls[54].
Critiques[modifier | modifier le code]
Selon deux revues de la littérature l'une effectué en 2015[55] par la Collaboration Cochrane, et l'autre[56] publié en juin 2017 dans la revue BioMed Research International (en). La réticulation pourrait stopper la progression du Kératocône pour au moins un an sous certaines conditions[56], mais les études observées présentent des biais méthodologiques mettant en doute leurs résultats[55]. Les deux revues concluent sur le manque de données dû au nombre insuffisant d'essais randomisés contrôlés comparables et donc le manque de preuves favorables à l'usage de cette opération dans le traitement du kératocône.
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Keratoconus » (voir la liste des auteurs).
- (en) J. Nottingham Practical observations on conical cornea: and on the short sight, and other defects of vision connected with it. London: J. Churchill, 1854. Archives canadiennes.
- (en) W. Bowman « On conical cornea and its treatment by operation » Ophthalmic Hosp Rep and J R Lond Ophthalmic Hosp. 1859;9,157
- (de)J.F. Horner « Zur Behandlung des Keratoconus » Klinische Monatsblätter für Augenheilkunde 1869
- (en) R.M. Pearson « Kalt, keratoconus and the contact lens » Optom Vis Sci. 1989;66,643
- (en) Brown D. National Keratoconus Foundation: Research Overview. http://www.nkcf.org. consulté le 12 février 2006.
- (en) M. Edwards, C.N. McGhee, S. Dean « The genetics of keratoconus » Clin Experiment Ophthalmol. 2001;29,345
- (en)K. Zadnik, J.T. Barr, T.B. Edrington, D.F. Everett, M. Jameson, T.T. McMahon, J.A. Shin, J.L. Sterling, H. Wagner, M.O. Gordon « Baseline findings in the Collaborative Longitudinal Evaluation of Keratoconus (CLEK) Study » Invest Ophthalmol Vis Sci. 1998;39,2537
- « Qu'est-ce que le kératocône ? - Centre Hospitalier Universitaire (CHU) de Toulouse », sur www.chu-toulouse.fr (consulté le )
- (en) S. Merin, Inherited Eye Disorders : Diagnosis and Management, Taylor & Francis Boca Raton, (ISBN 1-57444-839-0)
- (en) Y.S. Rabinowitz « Keratoconus » Surv Ophthalmol. 1998;42,297
- (en) C.W. McMonnies, G.C. Boneham « Keratoconus, allergy, itch, eye-rubbing and hand-dominance » Clin Exp Optom. 2003;86,376
- (en) A.M. Bawazeer, W.G. Hodge, B. Lorimer « Atopy and keratoconus: a multivariate analysis » Br J Ophthalmol. 2000;84,834
- (en) B. Jafri, H. Lichter, R.D Stulting « Asymmetric keratoconus attributed to eye rubbing » Cornea 2004;23,560
- (en) A.S. Ioannidis, L. Speedwell, K.K. Nischal « Unilateral keratoconus in a child with chronic and persistent eye rubbing » Am J Ophthalmol. 2005;139,356
- (en) R.G. Lindsay, A.S. Bruce, I.F. Gutteridge « Keratoconus associated with continual eye rubbing due to punctal agenesis » Cornea 2000;19,567
- (en) J.T. Barr, B.S. Wilson, M.O. Gordon, M.J. Rah, C. Riley, P.S. Kollbaum, K. Zadnik, CLEK Study Group « Estimation of the incidence and factors predictive of corneal scarring in the Collaborative Longitudinal Evaluation of Keratoconus (CLEK) Study » Cornea 2006;25,16
- (en) E. Spoerl, G. Wollensak, T. Seiler « Increased resistance of crosslinked cornea against enzymatic digestion » Curr Eye Res. 2004;29,35
- (en) T.P Gondhowiardjo, N.J. van Haeringen, H.J. Völker-Dieben, H.W. Beekhuis, J.H. Kok, G. van Rij, L. Pels, A. Kijlstra « Analysis of corneal aldehyde dehydrogenase patterns in pathologic corneas » Cornea 1993;2,146
- (en) US National Eye Institute, Facts About The Cornea and Corneal Disease Keratoconus. Consulté le 12 février 2006.
- (en) R.H. Kennedy, W.M. Bourne, J.A. Dyer « A 48-year clinical and epidemiologic study of keratoconus » Am J Ophthalmol. 1986;101,267
- (en) Weissman BA, Yeung KK. Keratoconus. eMedicine: Keratoconus. Consulté le 12 février 2006.
- (en) J.H. Krachmer, R.S. Feder, M.W. Belin « Keratoconus and related noninflammatory corneal thinning disorders » Surv Ophthalmol. 1984;28,293
- (en) B.A. Fink, H. Wagner, K. Steger-May, C. Rosenstiel, T. Roediger, T.T. McMahon, M.O. Gordon, K. Zadnik « Differences in keratoconus as a function of gender » Am J Ophthalmol. 2005;140,459
- (en) A.R. Pearson, B. Soneji, N. Sarvananthan, J.H. Sandford-Smith « Does ethnic origin influence the incidence or severity of keratoconus? » Eye 2000;4,625
- (en) L.T. Nordan « Keratoconus: diagnosis and treatment » Int Ophthalmol Clin. 1997;37,51
- (en) Zadnik K, The ocular examination : measurements and findings, W.B. Saunders Philadelphia, (ISBN 0-7216-5209-3)
- (en) T.B. Edrington, K. Zadnik, J.T. Barr « Keratoconus » Optom Clin. 1995;4,65.
- (en) L.J. Maguire, W.M. Bourne « Corneal topography of early keratoconus » Am J Ophthalmol. 1989;108,107
- (en) P. Caroline, M. Andre, B. Kinoshita, and J. Choo, « Etiology, Diagnosis, and Management of Keratoconus: New Thoughts and New Understandings »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Pacific University College of Optometry (consulté le )
- (en)[PDF]D. Gupta D, « Keratoconus: A clinical update »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) L.J. Davis « Keratoconus: Current understanding of diagnosis and management » Clin Eye Vis Care 1997;9:13–22 DOI 10.1016/S0953-4431(96)00201-9
- (en) S. Grewal, P.R. Laibson, E.J. Cohen, C.J. Rapuano « Acute hydrops in the corneal ectasias: associated factors and outcomes » Trans Am Ophthalmol Soc. 1999;97,187
- (en) M.P. Rubinstein, S. Sud « The use of hybrid lenses in management of the irregular cornea » Cont Lens Anterior Eye 1999;22,87
- (en) K. Yeung, F. Eghbali, B.A. Weissman « Clinical experience with piggyback contact lens systems on keratoconic eyes » J Am Optom Assoc. 1995;66,539 .
- (en) K.W. Pullum, R.J. Buckley « A study of 530 patients referred for rigid gas permeable scleral contact lens assessment » Cornea 1997;16,612
- (en) T. Schirmbeck, J.S. Paula, L.F. Martin, H. Crosio Filho, E. Romao « Efficacy and low cost in keratoconus treatment with rigid gas-permeable contact lens » Arq Bras Oftalmol. 2005;68,219.
- (en) M.A. Javadi, B.F. Motlagh, M.P. Jafarinasab, Z. Rabbanikhah, A. Anissian, H. Souri, S. Yazdani « Outcomes of penetrating keratoplasty in keratoconus » Cornea 2005;24,941.
- (en) N. Mamalis, C.W. Anderson, K.R. Kreisler, M.K. Lundergan, R.J. Olson « Changing trends in the indications for penetrating keratoplasty » Arch Ophthalmol. 1992;110:1409
- (en) H. Al-Mezaine, M.D. Wagoner « Repeat penetrating keratoplasty: indications, graft survival, and visual outcome » Br J Ophthalmol. 2006;90,324
- (en) R.S. Rubinfeld, E.I. Traboulsi, J.J. Arentsen, R.C. Eagle Jr. « Keratoconus after penetrating keratoplasty » Ophthalmic Surg. 1990, 21, 420
- (en) M.D. Wagoner, S.D. Smith, W.J. Rademaker, M.A. Mahmood « Penetrating keratoplasty vs. epikeratoplasty for the surgical treatment of keratoconus » J Refract Surg. 2001;17,138
- (en) US FDA, New Humanitarian Device Approval INTACS®, « Prescription Inserts for Keratoconus - H040002 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- (en) G. Simon, J.M. Parel, W. Lee, G.N. Kervick « Gel injection adjustable keratoplasty » Graefes Arch Clin Exp Ophthalmol. 1991;229,418
- (en) J. Ruckhofer « Clinical and histological studies on the intrastromal corneal ring segments (ICRS®, Intacs®) » Klin Monatsbl Augenheilkd. 2002;219:555
- (en) D. Miranda, M. Sartori, C. Francesconi, N. Allemann, P. Ferrara, M. Campos « Ferrara intrastromal corneal ring segments for severe keratoconus » J Refract Surg. 2003;19:645
- (en) B.S. Boxer Wachler, J.P. Christie, N.S. Chandra, B. Chou, T. Korn, R. Nepomuceno « Intacs for keratoconus » Ophthalmology 2003;110:1031
- (en) M. Sharma, B.S. Boxer Wachler « Comparison of single-segment and double-segment Intacs for keratoconus and post-LASIK ectasia » Am J Ophthalmol. 2006;141:891
- (en) N.S. Jabbur, W.J. Stark, W.R. Green « Corneal ectasia after laser-assisted in situ keratomileusis » Arch. Ophthal. 2001;119:1714
- (en) J. Colin, S. Velou « Current surgical options for keratoconus » J Cataract Refract Surg. 2003;29:379
- J.P. Bergmanson, E.J. Farmer « A return to primitive practice? Radial keratotomy revisited » Cont Lens Anterior Eye 1999;22,2
- (en) M. Lombardi, M. Abbondanza « Asymmetric radial keratotomy for the correction of keratoconus » J Refract Surg. 1997;13:302
- (en) E. Spoerl, G. Wollensak, D.D. Dittert, T. Seiler « Thermomechanical behavior of collagen-cross-linked porcine cornea » Ophthalmologica 2004;218:136
- « Crosslinking - CXL - Association kératocône - Le site des cornées KC ... », sur www.keratocone.net (consulté le )
- (en) C.C.K. Chan, M. Sharma, B.S. Boxer Wachler « The effect of inferior segment Intacs with and without corneal collagen crosslinking with riboflavin (C3-R) on keratoconus » J Cataract Refract Surg. 2007;33,75
- (en) E Sykakis, R Karim, JR Evans, C Bunce, KN Amissah-Arthur, S Patwary, PJ McDonnell et S Hamada, « Corneal collagen cross-linking for treating keratoconus. », The Cochrane database of systematic reviews, vol. 3, , p. CD010621 (PMID 25803325, DOI 10.1002/14651858.CD010621.pub2)
- (en) Hidenaga Kobashi et Shi Song Rong, « Corneal Collagen Cross-Linking for Keratoconus: Systematic Review », BioMed Research International, vol. 2017, , p. 1–7 (ISSN 2314-6133, DOI 10.1155/2017/8145651, lire en ligne, consulté le )
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) R. Arffa, Grayson's Diseases of the Cornea. Chap. 17, Saint Louis, Mosby, , 765 p. (ISBN 0-8151-3654-4)
- (en) D. Brown, « Research Overview », National Keratoconus Foundation (consulté le )
- (en) D. Burger, J. Shovlin, K. Zadnik, « Keratoconus: Diagnosis & Management », Pacific University College of Optometry, 2003 (consulté le )
- (en) P. Caroline, M. Andre, B. Kinoshita, and J. Choo, « Etiology, Diagnosis, and Management of Keratoconus: New Thoughts and New Understandings », Pacific University College of Optometry (consulté le )
- (en) [PDF] A. Epstein, « Keratoconus and related disorders », North Shore Contact Lens, 2000 (consulté le )
- (en) R. Feder et P. Kshettry, Cornea, Mosby, (ISBN 0-323-02315-0), « Chap 78: Non-inflammatory Ectactic Disorders »
- (en) V. Heverly, G. Lowther, « Keratoconus », School of Optometry, Indiana University (consulté le )
- (en) Y. Rabonitz, The Cornea, Philadelphia etc., Edited: Foster C et al., , 1323 p. (ISBN 0-7817-4206-4), « Ectatic Disorders of the Cornea »
- (en) M. Yanoff et J. Duker, Ophthalmology, Mosby, (ISBN 0-323-01634-0)
- (en) K. Zadnik et J. Barr, Diagnosis, Contact Lens Prescribing, and Care of the Keratoconus Patient, Butterworth Heinemann, (ISBN 0-7506-9676-1)
Liens externes[modifier | modifier le code]
- Le site de l'Association Kératocône
- Le site du syndicat national des ophtalmologistes de France
- Le site des maladies rares
- (en)http://www.kcglobal.org
- (en)http://www.keratoconusinternational.com
- EuroKératocône II - Congrès européen 2011 - 23 et 24 septembre 2011. Bordeaux - France

