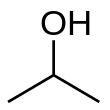
Alcool isopropylique
| Isopropanol | |
  |
|
| Formule topologique et représentation 3D de l'isopropanol | |
| Identification | |
|---|---|
| Nom UICPA | Propan-2-ol |
| Synonymes |
2-Propanol |
| No CAS | |
| No ECHA | 100.000.601 |
| No CE | 200-661-7 |
| DrugBank | DB02325 |
| PubChem | |
| FEMA | 2929 |
| Apparence | liquide incolore[1]. |
| Propriétés chimiques | |
| Formule | C3H8O [Isomères] |
| Masse molaire[3] | 60,095 ± 0,003 3 g/mol C 59,96 %, H 13,42 %, O 26,62 %, |
| pKa | 16,5 (hydrogène du groupe hydroxyle) |
| Moment dipolaire | 1,69 D (gaz)[2] |
| Propriétés physiques | |
| T° fusion | −88,5 °C[2] |
| T° ébullition | 82,5 °C[2] |
| Solubilité | > 10 % dans alcool ; 10 % dans éther ; 10 % dans acétone ; Sol dans le benzène[2] |
| Paramètre de solubilité δ | 23,7 J1/2·cm-3/2 (25 °C)[4] |
| Miscibilité | miscible avec l'eau et la plupart des solvants organiques[2] |
| Masse volumique | 0,78505 [2]
|
| T° d'auto-inflammation | 456 °C[1] ; 399 °C[2] |
| Point d’éclair | 11,7 °C (coupelle fermée)[1] 23,9 °C (coupelle ouverte) (isopropanol à 91 %)[2] |
| Limites d’explosivité dans l’air | inférieure : 2,5 % vol, supérieure : 12,0 % vol[2] |
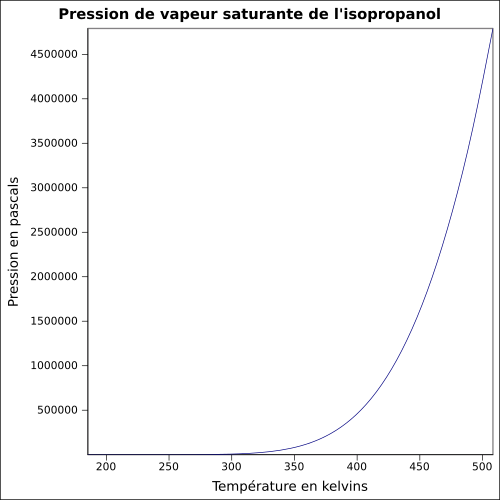
| Pression de vapeur saturante | à 20 °C : 4,4 kPa[1]
|
| Viscosité dynamique | 4,564 6×10-3 Pa·s à 0 °C 2,370 3×10-3 Pa·s à 20 °C 1,331 1×10-3 Pa·s à 40 °C[6] |
| Point critique | 235,15 °C, 5,37 MPa, 0,222 l·mol-1[7] |
| Thermochimie | |
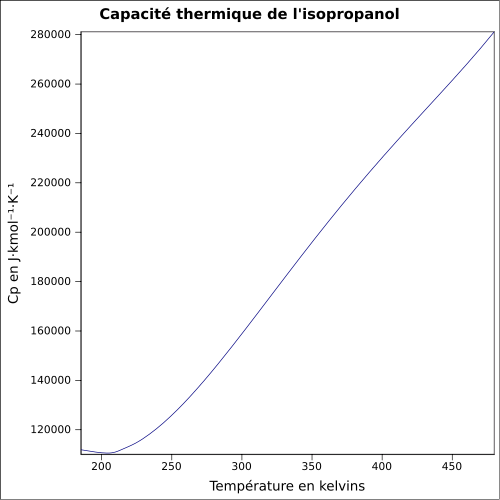
| Cp | |
| PCS | −2 005 kJ·mol-1 |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,17 ± 0,02 eV (gaz)[9] |
| Propriétés optiques | |
| Indice de réfraction | 1,3852 ; 1,3802 ; 1,37723 ; 1,3749 [2] |
| Précautions | |
| SGH[12] | |
| H225, H319 et H336 |
|
| SIMDUT[13] | |
  B2, D2B, |
|
| NFPA 704[2] | |
| Transport | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[11] | |
| Inhalation | maux de tête, vertige, dépression mentale nausée, vomissement, anesthésie et coma |
| Peau | Possibilité d'irritation douloureuse et urticante faible risque de réactions cutanées allergiques rares cas de dermatite de contact allergique |
| Yeux | irritation (sensation de brûlure, rougeurs, larmoiement, voire lésion cornéenne) Possibilité de lésion cornéenne transitoire. |
| Écotoxicologie | |
| DL50 | 3 600 mg·kg-1 (souris, oral) 1 509 mg·kg-1 (souris, i.v.) 4 477 mg·kg-1 (souris, i.p.)[14] |
| CL50 | 16 000 ppm / 8 h (rat, inhalation)[14] |
| LogP | 0,05[1] |
| Seuil de l’odorat | bas : 1 ppm haut : 610 ppm[15] |
| Données pharmacocinétiques | |
| Demi-vie d’élim. | 3 heures |
| Composés apparentés | |
| Isomère(s) | propan-1-ol |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'alcool isopropylique (aussi connu sous son nom erroné[16] d'isopropanol) est le nom commun pour le propan-2-ol, composé chimique sans couleur et inflammable dont la formule chimique est CH3CH(OH)-CH3. C'est l'un des deux isomères du propanol (l'autre étant le propan-1-ol). Il est aussi connu sous son nom abrégé IPA (acronyme de l'anglais IsoPropyl Alcohol). Au laboratoire, on l'appelle souvent « isoprop » ([izopʁɔp]) mais cela reste réservé à un usage trivial et oral du nom.
Production et synthèse
Il est obtenu à partir de la réduction de l'acétone par le tétrahydruroborate de sodium.
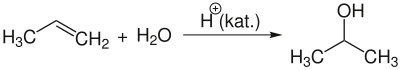
Un autre procédé de fabrication consiste en une hydratation indirecte du propylène par l'acide sulfurique à 70 %, suivie d'une hydrolyse qui conduit à l'isopropanol.
Utilisation
Il est utilisé dans une des deux formulations des produits hydro-alcooliques recommandés par l’OMS (la première étant à base d'éthanol) à une concentration de 99.8% et testée par des laboratoires de référence de l’OMS conformément aux normes EN (EN 1500). Les garnitures de stérilisation contiennent typiquement une solution de 72 % d'isopropanol dilué dans l'eau. L'alcool isopropylique est également utilisé comme décapant et dissolvant dans l'industrie. C'est un bon dégraissant. Il est également employé comme additif de l'essence. Il est employé comme désinfectant (surface inerte) et antiseptique (tissu vivant), et est un dissolvant commun. Il est utilisé aussi pour les massages des muscles douloureux : c'est l'alcool à friction. L'isopropanol est aussi utilisé dans les chambres à brouillard, ou chambre de Wilson, expérience surprenante révélant le passage de certaines particules comme les muons. Il peut être aussi utilisé dans les collections animales pour les musées. Les espèces sont conservées dans un bocal avec de l'alcool dilué. L'isopropanol est l'essence utilisée pour les Lampes Berger. L'alcool isopropylique pur (à plus de 99 %) est utilisé en imprimerie (procédé offset). Il permet de réduire la tension superficielle de la solution de mouillage, tout en augmentant sa viscosité. Par souci pour l'environnement, les dosages diminuent, et il est remplacé par des additifs moins nocifs. Les États-Unis n'utilisent plus d'alcool en imprimerie depuis les années 1980. L'isopropanol est enfin utilisé en biologie moléculaire afin d'insolubiliser l'ADN lors de la préparation de celui ci à partir d'extraits cellulaires.
Précaution
L'alcool isopropylique est inflammable et irritant. Il doit être maintenu loin de la chaleur et de toute flamme. Les symptômes de l'empoisonnement à l'isopropanol se traduisent par des maux de tête, vertiges, dépression mentale, nausées, vomissements, narcolepsie et coma. Il est conseillé de l'utiliser dans des endroits bien aérés avec des gants protecteurs.
Notes et références
- ALCOOL ISOPROPYLIQUE, Fiches internationales de sécurité chimique
- « ISOPROPANOL », sur toxnet.nlm.nih.gov, Hazardous Substances Data Bank (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Lange's Handbook of Chemistry, 10th ed. pp 1669-1674
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « propane-2-ol », sur ESIS, consulté le 18 février 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur monographs.iarc.fr, CIRC, (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Alcool isopropylique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) « Alcool isopropylique », sur ChemIDplus, consulté le 23 août 2009
- « Isopropyl alcohol », sur hazmap.nlm.nih.gov (consulté le )
- « Alcohols Rule C-201.1 ». Nomenclature of Organic Chemistry (The IUPAC 'Blue Book'), Sections A, B, C, D, E, F, and H. Oxford: Pergamon Press. 1979. "Designations such as isopropanol, sec-butanol, and tert-butanol are incorrect because there are no hydrocarbons isopropane, sec-butane, and tert-butane to which the suffix "-ol" can be added; such names should be abandoned. Isopropyl alcohol, sec-butyl alcohol, and tert-butyl alcohol are, however, permissible (see Rule C-201.3) because the radicals isopropyl, sec-butyl, and tert-butyl do exist."