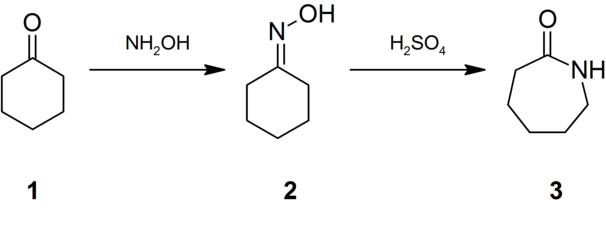Réarrangement de Beckmann
En chimie organique, un réarrangement de Beckmann, nommé d'après le chimiste allemand Ernst Otto Beckmann, est une réaction de réarrangement qui permet de convertir une oxime (cétoxime ou aldoxime) en carboxamide et implique la migration d'un groupe alkyle sur un atome d'azote rendu électrophile[1]. Ce réarrangement a également été réalisé sur des halo-imines et des nitrones ; les halo-imines et oximes cycliques donnent des lactames.
-
Mécanisme de réaction du réarrangement de Beckmann. Le marquage bleu met en évidence le réarrangement des atomes.
Dans le cas d'une cétoxime, R1 et R2 sont des résidus organyle ; dans le cas des aldoximes, l'un des groupes résiduels est un atome d'hydrogène. La fragmentation de Beckmann est une autre réaction qui entre souvent en compétition avec le réarrangement, bien qu'un choix précis du catalyseur et du solvant peuvent favoriser l'une ou l'autre réaction, parfois en ne donnant qu'un seul produit.
Cette réaction de réarrangement repose sur la conversion du groupe hydroxyle de l'oxime en un groupe partant à l'aide d'un acide (de Lewis ou non), d'un anhydride ou d'un halogénure d'acyle. Ainsi, le chlorure de tosyle CH3C6H4SO2Cl, le chlorure de thionyle SOCl2, le pentachlorure de phosphore PCl5, le pentoxyde de phosphore P4O10, la triéthylamine N(CH2CH3)3, l'hydroxyde de sodium NaOH et l'iodure de triméthylsilyle ISi(CH3)3 favorisent cette réaction[2]. Le réarrangement est stéréospécifique pour les cétoximes et les N-chloro/N-fluoroimines, le groupe migrant étant antipériplanaire au groupe partant sur l'atome d'azote. Certaines conditions sont connues pour racémiser l'oxime, aboutissant à la formation des deux régioisomères (en). Les réarrangement des aldoximes est stéréospécifique en phase gazeuse mais pas en solution. Certaines procédures permettent le réarrangement d'aldoximes en amides primaires, mais la fragmentation entre généralement en compétition avec le réarrangement dans ce cas. Le réarrangement des nitrones n'est pas non plus stéréospécifique ; l'atome d'azote du régioisomère formé est substitué avec le groupe qui présente la meilleure aptitude migratoire (en).
L'archétype du réarrangement de Beckmann est la conversion de la cyclohexanone (1) en caprolactame (3) via l'oxime de cyclohexanone[3] (2), le caprolactame étant la matière première de la production du nylon 6[4] :
-
Conversion de la cyclohexanone (1) en caprolactame (3).
Une solution de Beckmann est un mélange de solutions aqueuses d'acide acétique CH3COOH, acide chlorhydrique HCl et d'anhydride acétique (CH3CO)2O largement utilisé pour catalyser le réarrangement. D'autres acides tels que l'acide sulfurique H2SO4, l'acide pyrophosphorique H4P2O7 et le fluorure d'hydrogène HF sont également utilisés. L'acide sulfurique est le plus couramment employé pour la production de lactames car il forme du sulfate d'ammonium (NH4)2SO4 lorsqu'il est neutralisé avec l'ammoniac NH3 ; le sulfate d'ammonium est un engrais répandu qui apporte de l'azote et du soufre.
Mécanisme
La formation d'un amide secondaire R2CONHR1 par réarrangement d'une cétoxime R1(CNOH)R2 commence généralement par la protonation de cette dernière sur l'hydroxyle. Une molécule d'eau est éliminée et le groupe R1, en position E (anti) par rapport à l'hydroxyle, migre vers l'atome d'azote pour former un ion nitrilium. L'attaque nucléophile d'une molécule d'eau par solvolyse donne un imidate par déprotonation, lequel conduit à l'amide par tautomérisation[5] :
La formation d'un nitrile RCN par « déshydratation » d'une aldoxime R(CNOH)H, par exemple sous l'effet du pentachlorure de phosphore PCl5, se déroule selon un mécanisme analogue :
Une étude par simulation numérique a pu déterminer un mécanisme prenant en compte les molécules du solvant et les substituants[6]. Le réarrangement de l'oxime d'acétone (CH3)2C=NOH dans une solution de Beckmann fait intervenir trois molécules d'acide acétique CH3COOH et un proton sous forme d'ion hydronium H3O+. Dans l'état de transition aboutissant à l'ion iminium (complexe σ), le groupe méthyle antipériplanaire migre sur l'atome d'azote lors d'une réaction concertée avec l'élimination de l'hydroxyle. L'atome d'oxygène de l'hydroxyle est stabilisé par trois molécules d'acide acétique. À l'étape suivante, l'atome de carbone électrophile de l'ion nitrilium est attaqué par l'eau, et un proton est cédé à l'acide acétique. Dans l'état de transition conduisant à l'imidate, l'atome d'oxygène de l'eau est coordonné à quatre autres atomes. Dans la troisième étape, une étape d'isomérisation conduit à la protonation de l'atome d'azote et à la formation de l'amide.
Notes et références
- (en) Ernst Beckmann, « Zur Kenntniss der Isonitrosoverbindungen », Berichte der deutschen chemischen Gesellschaft, vol. 19, no 1, , p. 988-993 (DOI 10.1002/cber.188601901222, lire en ligne)
- (en) Robert E. Gawley, « The Beckmann Reactions: Rearrangements, Elimination–Additions, Fragmentations, and Rearrangement–Cyclizations », Organic Reactions, (DOI 10.1002/0471264180.or035.01, lire en ligne)
- (en) J. C. Eck et C. S. Marvel, « ε-Benzoylaminocaproic Acid », Organic Syntheses, vol. 19, , p. 20 (DOI 10.15227/orgsyn.019.0020, lire en ligne)
- (en) Johan Tinge, Marijke Groothaert, Hans op het Veld, Josef Ritz, Hugo Fuchs, Heinz Kieczka et William C. Moran, « Caprolactam », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a05_031.pub3, lire en ligne)
- (en) Inés Lezcano-González, Mercedes Boronat et Teresa Blasco, « Investigation on the Beckmann rearrangement reaction catalyzed by porous solids: MAS NMR and theoretical calculations », Solid State Nuclear Magnetic Resonance, vol. 35, no 2, , p. 120-129 (PMID 19286355, DOI 10.1016/j.ssnmr.2009.02.001, lire en ligne)
- (en) Shinichi Yamabe, Noriko Tsuchida et Shoko Yamazaki, « Is the Beckmann Rearrangement a Concerted or Stepwise Reaction? A Computational Study », The Journal of Organic Chemistry, vol. 70, no 26, , p. 10638-10644 (PMID 16355980, DOI 10.1021/jo0508346, lire en ligne)