Flavone (groupe)

Les flavones (du latin flavus, jaune) sont une sous-famille des flavonoïdes dont la structure est basée sur la flavone (2-phényl-1-benzopyran-4-one ou 2-phénylchromén-4-one). Ce sont des colorants végétaux jaunes dont environ 300 composés naturels sont connus. Comme d'autres flavonoïdes (hypéroside, quercitrine), elles sont parfois présentes sous forme d'hétérosides solubles dans l'eau. On les trouve parfois comme co-pigment avec les anthocyanes.
Les flavones 3-hydroxylées (portant un groupe alcool sur le carbone 3) sont appelées flavonols et forment une autre sous-famille des flavonoïdes.
Principales flavones
Flavones naturelles
| Nom | Structure | R5 | R6 | R7 | R8 | R3' | R4' | R5' | CAS | Nom IUPAC |
|---|---|---|---|---|---|---|---|---|---|---|
| Flavone | 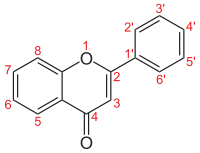 |
H | H | H | H | H | H | H | 2-phénylchromèn-4-one | |
| Apigénine | OH | H | OH | H | H | OH | H | 5,7-dihydroxy-2-(4-hydroxyphényl)chromèn-4-one | ||
| Acacétine | OH | H | OH | H | H | OCH3 | H | 5,7-dihydroxy-2-(4-méthoxyphényl)chromèn-4-one | ||
| Baicaléine | OH | OH | OH | H | H | H | H | 5,6,7-trihydroxy-2-phénylchromèn-4-one | ||
| Chrysine | OH | H | OH | H | H | H | H | 5,7-dihydroxy-2-phénylchromèn-4-one | ||
| Chrysoériol | OH | H | OH | H | OCH3 | OH | H | 5,7-dihydroxy-2-(4-hydroxy-3-méthoxy-phényl)chromèn-4-one | ||
| Diosmétine | OH | H | OH | H | OH | OCH3 | H | 5,7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl)chromèn-4-one | ||
| Eupatiline | OH | OCH3 | OH | H | OCH3 | OCH3 | H | 5,7-dihydroxy-2-(3,4-diméthoxyphényl)chromèn-4-one | ||
| Eupatorine | OH | OCH3 | OCH3 | H | OH | OCH3 | H | 5,7-dihydroxy-6-méthoxy-2-(3-hydroxy-4-methoxyphenyl)chromèn-4-one | ||
| Genkwanine | OH | H | OCH3 | H | H | OH | H | 5-hydroxy-7-méthoxy-2-(4-hydroxy-phényl)chromèn-4-one | ||
| 6-hydroxyflavone | H | OH | OH | H | H | H | H | 6-hydroxy-2-phénylchromèn-4-one | ||
| Lutéoline | OH | H | OH | H | OH | OH | H | 5,7-dihydroxy-2-(3,4-dihydroxyphényl)chromèn-4-one | ||
| Népétine | OH | OCH3 | OH | H | OH | OH | H | 5,7-dihydroxy-6-méthoxy-2-(3,4-dihydroxyphényl)chromén-4-one | ||
| Nobilétine | OCH3 | OCH3 | OCH3 | OCH3 | OCH3 | OCH3 | H | 5,6,7,8-téraméthoxy-2-(3,4-méthoxyphényl)chromèn-4-one | ||
| Oroxyline A | OH | OCH3 | OH | H | H | H | H | 5,7-dihydroxy-6-méhtoxy-2-phénylchromèn-4-one | ||
| Scutellaréine | OH | OH | OH | H | H | OH | H | 5,6,7-trihydroxy-2-(4-hydroxyphényl)chromèn-4-one | ||
| Sinensétine | OCH3 | OCH3 | OCH3 | H | OCH3 | OCH3 | H | 5,6,7-triméthoxy-2-(3,4-diméthoxyphényl)chromèn-4-one | ||
| Tangéritine | OCH3 | OCH3 | OCH3 | OCH3 | H | OCH3 | H | 5,6,7,8-tétraméthoxy-2-(4-méthoxyphényl)chromèn-4-one | ||
| Techtochrysine | OH | H | OCH3 | H | H | H | H | 5-hydroxy-7-méthoxy-2-phénylchromèn-4-one | ||
| Tricine | OH | H | OH | H | OCH3 | OH | OCH3 | 5,7-dihydroxy-2-(4-hydroxy-3,5-diméthoxyphényl)chromèn-4-one | ||
| Wogonine | OH | H | OH | OCH3 | H | H | H | 5,7-dihydroxy-8-méhtoxy-2-phénylchromèn-4-one |
Flavones synthétiques
De nombreuses flavones ont été synthétisées et servent par exemple de médicament. On peut notamment citer le flavoxate, la diosmine (hétéroside) ou encore l'hidrosmine.
Hétérosides de flavones
Synthèse de flavones
En chimie organique, il existe différente méthodes permettant de synthétiser les flavones :
- la réaction d'Allan-Robinson
- la synthèse d'Auwers
- le réarrangement de Baker-Venkataraman
- la réaction d'Algar-Flynn-Oyamada
Une autre méthode passe par la cyclisation déshydratante de certaines 1,3-diaryl dicétones[1]

Cette méthode particulière utilise un solvant qui est un liquide ionique et une irradiation par micro-ondes.
Réarrangement de Wessely-Moser
Le réarrangement de Wessely-Moser (1930) [2] a été un outil important dans la découverte de la structure des flavonoïdes. Il permet la conversion de 5,7,8-triméthoxyflavones en 5,6,7-trihydroxyflavones par hydrolyse des groupes methoxy en groupe hydroxy (phénols).
Ce réarrangement ouvre aussi des perspectives pour certaines synthèses. Par exemple[3]:
Le réarrangement se produit à différentes étapes: A ouverture du cycle pour donner la dicétone, B rotation de la liaison avec formation d'un composé de type acétylacétone, et C hydrolyse des deux groupes méthoxy et fermeture du cyle.
Consommation et effets supposés
Les flavones sont particulièrement présentes dans les céréales et les herbes. Dans le monde occidental, la consommation en flavones est estimée entre 20 et 50 mg par jour[4]. Ces dernières années, l'intérêt du monde scientifique et du grand public pour les flavones s'est accru du fait de leurs supposés effets bénéfiques contre l'athérosclérose, l'ostéoporose, le diabète et certains cancers[5]. Les études actuelles sur la prise de flavones et d'autres extraits de plantes en compléments alimentaires se multiplient.
Interactions médicamenteuses
Les flavones ont un effet sur l'activité des CYP (p450)[6],[7], enzymes métabolisant la plupart des médicaments dans le corps.
Notes et références
- (en) Sarda SR, Pathan MY, Paike VV, Pachmase PR, Jadhav WN, Pawar RP, « A facile synthesis of flavones using recyclable ionic liquid under microwave irradiation », Arkivoc, vol. xvi, , p. 43–8 (lire en ligne)
- (en) Wessely F, Moser GH, « Synthese und Konstitution des Skutellareins », Monatsh. Chem., vol. 56, no 1, , p. 97–105 (DOI 10.1007/BF02716040, lire en ligne)
- (en) Larget R, Lockhart B, Renard P, Largeron M, « A convenient extension of the Wessely-Moser rearrangement for the synthesis of substituted alkylaminoflavones as neuroprotective agents in vitro », Bioorg. Med. Chem. Lett., vol. 10, no 8, , p. 835–8 (PMID 10782697, DOI 10.1016/S0960-894X(00)00110-4, lire en ligne)
- (en) Cermak R, Wolffram S, « The potential of flavonoids to influence drug metabolism and pharmacokinetics by local gastrointestinal mechanisms », Curr. Drug Metab., vol. 7, no 7, , p. 729–44 (PMID 17073577, DOI 10.2174/138920006778520570, lire en ligne)
- (en) Cermak R, « Effect of dietary flavonoids on pathways involved in drug metabolism », Expert Opin Drug Metab Toxicol, vol. 4, no 1, , p. 17–35 (PMID 18370856, DOI 10.1517/17425255.4.1.17, lire en ligne)
- Cermak R, Wolffram S., The potential of flavonoids to influence drug metabolism and pharmacokinetics by local gastrointestinal mechanisms,Curr Drug Metab. 2006 Oct;7(7):729-44.
- (en) Si D, Wang Y, Zhou YH, et al., « Mechanism of CYP2C9 inhibition by flavones and flavonols », Drug Metab. Dispos., vol. 37, no 3, , p. 629–34 (PMID 19074529, DOI 10.1124/dmd.108.023416, lire en ligne)[1]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « flavones » (voir la liste des auteurs).

