Eupatorine
| Eupatorine | |
| |
| Identification | |
|---|---|
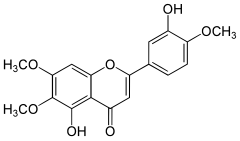
| Nom UICPA | 5-hydroxy-2-(3-hydroxy-4-méthoxyphényl)-6,7-diméthoxychromèn-4-one |
| No CAS | |
| No ECHA | 100.189.469 |
| PubChem | 97214 |
| SMILES | |
| InChI | |
| Apparence | poudre jaune foncé[1] |
| Propriétés chimiques | |
| Formule | C18H16O7 [Isomères] |
| Masse molaire[2] | 344,315 4 ± 0,017 6 g/mol C 62,79 %, H 4,68 %, O 32,53 %, |
| Précautions | |
| SGH[1] | |
| H301 et P301+P310+P330 |
|
| Écotoxicologie | |
| LogP | 2,683[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'eupatorine est un composé aromatique de la famille des flavones. Elle est présente dans diverses espèces végétales de la tribu des Eupatorieae (en), entre autres dans le genre Eupatorium (Eupatorium semiserratum[3], Eupatorium altissimum), mais aussi dans Merrillia caloxylon[4], Hyptis tomentosa[5], Lantana montevidensis[6], Centaurea arenaria[7], Lippia dulcis[8], Teucrium polium[9], Salvia limbata[10], Tanacetum vulgare[11], et Orthosiphon stamineus[12].
L'eupatorine influence la mitose et conduit à la polyploïdie et à l'apoptose[13]. L'eupatorine a des effets antiprolifératifs contre les cellules tumorales chez les mammifères et est dégradé par le cytochrome P1[14]. Elle inhibe en même temps le cytochrome P1[15] et la protéine STAT1α (en)[16]. L'eupatorine inhibe l'expression génétique de l'iNOS et de la COX-2 et a donc des effets anti-inflammatoires[16].
Notes et références
[modifier | modifier le code]- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Eupatorin » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Eupatorin analytical standard, consultée le 12 septembre 2020..
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- S. M. Kupchan, J. R. Knox, M. S. Udayamurthy: Tumor inhibitors. 8. Eupatorin, new cytotoxic flavone from Eupatorium semiserratum. In: Journal of pharmaceutical sciences. volume 54, numéro 6, juin 1965, p.929–930, .
- J. H. Adams, J. R. Lewis: Eupatorin, a constituent of Merrillia caloxylon. In: Planta medica. volume 32, numéro 1, août 1977, p.86–87, DOI 10.1055/s-0028-1097564, .
- D. G. Kingston, M. M. Rao, W. V. Zucker: Plant anticancer agents. IX. Constituents of Hyptis tomentosa. In: Journal of natural products. volume 42, numéro 5, 1979 Sep-Oct, p.496–499, .
- T. Nagao, F. Abe, J. Kinjo, H. Okabe: Antiproliferative constituents in plants 10. Flavones from the leaves of Lantana montevidensis Briq. and consideration of structure-activity relationship. In: Biological & pharmaceutical bulletin. volume 25, numéro 7, juillet 2002, p.875–879, .
- B. Csapi, Z. Hajdú, I. Zupkó, A. Berényi, P. Forgo, P. Szabó, J. Hohmann: Bioactivity-guided isolation of antiproliferative compounds from Centaurea arenaria. In: Phytotherapy research : PTR. volume 24, numéro 11, novembre 2010, p.1664–1669, DOI 10.1002/ptr.3187, .
- M. Ono, H. Morinaga, C. Masuoka, T. Ikeda, M. Okawa, J. Kinjo, T. Nohara: New Bisabolane-Type Sesquiterpenes from the Aerial Parts of Lippia dulcis. In: Chemical & pharmaceutical bulletin. volume 53, numéro 9, septembre 2005, p.1175–1177, .
- E. Verykokidou-Vitsaropoulou, C. Vajias: Methylated Flavones from Teucrium polium. In: Planta medica. numéro 5, Oktober 1986, p.401–402, DOI 10.1055/s-2007-969198, .
- A. R. Gohari, S. Saeidnia, M. Malmir, A. Hadjiakhoondi, Y. Ajani: Flavones and rosmarinic acid from Salvia limbata. In: Natural Product Research. volume 24, numéro 20, décembre 2010, p.1902–1906, DOI 10.1080/14786411003766912, .
- G. R. Schinella, R. M. Giner, M. C. Recio, P. Mordujovich de Buschiazzo, J. L. Ríos, S. Máñez: Anti-inflammatory effects of South American Tanacetum vulgare. In: The Journal of pharmacy and pharmacology. volume 50, numéro 9, septembre 1998, p.1069–1074, .
- Y. Tezuka, P. Stampoulis, A. H. Banskota, S. Awale, K. Q. Tran, I. Saiki, S. Kadota: Constituents of the Vietnamese medicinal plant Orthosiphon stamineus. In: Chemical & pharmaceutical bulletin. volume 48, numéro 11, novembre 2000, p.1711–1719, .
- A. L. Salmela, J. Pouwels, A. Kukkonen-Macchi, S. Waris, P. Toivonen, K. Jaakkola, J. Mäki-Jouppila, L. Kallio, M. J. Kallio: The flavonoid eupatorin inactivates the mitotic checkpoint leading to polyploidy and apoptosis. In: Experimental cell research. volume 318, numéro 5, mars 2012, p.578–592, DOI 10.1016/j.yexcr.2011.12.014, .
- V. Androutsopoulos, R. R. Arroo, J. F. Hall, S. Surichan, G. A. Potter: Antiproliferative and cytostatic effects of the natural product eupatorin on MDA-MB-468 human breast cancer cells due to CYP1-mediated metabolism. In: Breast cancer research : BCR. volume 10, numéro 3, 2008, p.R39, DOI 10.1186/bcr2090, , PMC 2481486.
- V. P. Androutsopoulos, A. Papakyriakou, D. Vourloumis, D. A. Spandidos: Comparative CYP1A1 and CYP1B1 substrate and inhibitor profile of dietary flavonoids. In: Bioorganic & medicinal chemistry. volume 19, numéro 9, mai 2011, p.2842–2849, DOI 10.1016/j.bmc.2011.03.042, .
- M. Laavola, R. Nieminen, M. F. Yam, A. Sadikun, M. Z. Asmawi, R. Basir, J. Welling, H. Vapaatalo, R. Korhonen, E. Moilanen: Flavonoids eupatorin and sinensetin present in Orthosiphon stamineus leaves inhibit inflammatory gene expression and STAT1 activation. In: Planta medica. volume 78, numéro 8, mai 2012, p.779–786, DOI 10.1055/s-0031-1298458, .

