Taurate
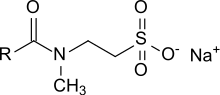
Les taurates sont des tensioactifs anioniques doux formés d'une tête hydrophile, constituée de N-méthyltaurine (acide 2-méthylaminoéthanesulfonique) CH3N+H2CH2CH2SO3−, et d'un résidu lipophile tel que CH3(CH2CH2)nCOOH, à savoir un acide carboxylique à longue chaîne (acide gras) avec n = 3 à 8, liés par une liaison amide. Les acides gras utilisés peuvent être de l'acide laurique (C12:0), myristique (C14:0), palmitique (C16:0) ou stéarique (C18:0), mais on utilise principalement des mélanges d'acide oléique (cis-Δ9 C18:1) et d'huile de coco (de C8 à C18). Les taurates sont utilisés comme tensioactifs doux et très moussants dans les produits de nettoyage corporel et de soins personnels (shampooings, savons et nettoyants liquides, lotions pour le visage, crèmes pour la peau, bains moussants), le traitement des textiles (agents mouillants et détergents, dispersants de colorants), dans les formulations phytosanitaires et dans d'autres applications industrielles.
Propriétés générales[modifier | modifier le code]
À température ambiante, les taurates sont généralement des masses pâteuses, facilement solubles dans l'eau en donnant des solutions neutres à légèrement basiques (pH 7 à 8). Ils sont peu toxiques, une dose létale médiane par voie orale de 6 630 mg/kg ayant été mesurée chez le rat de laboratoire pour le taurate de cocoyle méthyle sodium[1]. Ils sont facilement biodégradables, ne sont pas sujets à la bioaccumulation, mais ils sont nocifs pour les organismes aquatiques, comme tous les tensioactifs. En raison de leur liaison amide, les taurates sont stables dans une plage de pH plus large (de 2 à 10 environ) que les esters correspondants, tels que les iséthionates. Ce sont des tensioactifs très doux avec un bon pouvoir moussant, donnant une mousse stable même en présence de graisses et d'huiles. Les taurates conservent leurs bonnes propriétés de lavage même en eau dure ou dans l'eau de mer. Ils peuvent être utilisé comme co-tensioactifs à des concentrations d'environ 2 % en raison de leur bonne compatibilité avec tous les tensioactifs anioniques et non ioniques.
Production[modifier | modifier le code]
Les taurates ont d'abord été produits par réaction de Schotten-Baumann entre chlorures d'acyle à longue chaîne et solutions aqueuses du sel de sodium de la N-méthyltaurine CH3N+H2CH2CH2SO3Na :

La formation de quantités au moins équimolaires de chlorure de sodium NaCl est problématique, car NaCl détériore les propriétés des mélanges de tensioactifs avec ces taurates. La teneur élevée en sel rend également les taurates résultants hygroscopiques et corrosifs. Un autre inconvénient de la méthode Schotten-Baumann est la dangerosité des réactifs employés, comme le trichlorure de phosphore PCl3, des intermédiaires, comme les chlorures d'acyle, et l'accumulation de grandes quantités de déchets, comme les acides phosphoniques. Ce mode de production est donc compliqué et coûteux, mais présente l'avantage de limiter fortement la teneur en acides gras libres dans le produit final.
Un autre mode de production des taurates fait intervenir l'amidation directe de la N-méthyltaurine ou de son sel de sodium avec l'acide gras correspondant pendant 10 heures à 220 °C sous atmosphère d'azote[2],[3] :
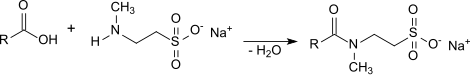
L'excès d'acide gras, ajouté pour déplacer l'équilibre de la réaction, demeure dans le produit final, ce qui peut interférer avec certaines applications. La décomposition de la N-méthyltaurine commence à des températures supérieures à 200 °C de sorte que les taurates qui en résultent s'assombrissent et développent une odeur désagréable. C'est la raison pour laquelle on cherche à adoucir les conditions opératoires à l'aide de catalyseurs appropriés, comme le borohydrure de sodium NaBH4[4], l'acide borique H3BO3 et l'oxyde de zinc ZnO[5].
Notes et références[modifier | modifier le code]
- (en) S. S. Hopper, H. R. Hulpieu, Versa V. Cole, « Some toxicological properties of surface-active agents », Journal of the American Pharmaceutical Association, vol. 38, no 8, , p. 428-432 (PMID 18137875, DOI 10.1002/jps.3030380804, lire en ligne)
- (en) L. W. Burnette et M. E. Chiddix, « Reaction of fatty acids with N-methyl taurine », Journal of the American Oil Chemists' Society, vol. 39, no 11, , p. 477-478 (DOI 10.1007/BF02637229, lire en ligne)
- (en) Llewellyn W. Burnette et Max E. Chiddix pour GAF Chemicals Corp, Brevet U.S. 2880219A : Production of n-acyl taurides, déposé le 22 novembre 1954, publié le 31 mars 1959, sur Google Patents.
- (en) Ismail I. Walele et Samad A. Syed pour Innospec Active Chemicals LLC, Brevet U.S. 5434276A : Process for making N-acyl taurides, déposé le 27 décembre 1993, publié le 18 juillet 1995, sur Google Patents.
- (en) James F. Day pour MIANO ROSEMARY M, Brevet U.S. 5496959A : Preparation of N-acyl taurates, déposé le 23 mai 1994, publié le 5 mars 1996, sur Google Patents.
