Opsine

Les opsines forment une famille de protéines capables de réagir à l'énergie lumineuse grâce à sa liaison avec un chromophore particulier : le rétinal ou un de ses dérivés[2], formant ainsi une molécule mixte appelée rhodopsine. Ces protéines sont présentes dans l'ensemble du vivant, et sont impliquées dans la grande majorité des processus de photosensibilité.
On connaît bien deux catégories d'opsines :
- les trois opsines de la bactérie Halobacterium halobium, qui forment, associées à un chromophore rétinoïde, la bactériorhodopsine (bR), l'halorhodopsine (hR) et la rhodopsine sensorielle (sR) ;
- les opsines formant les rhodopsines visuelles, contenues dans les cellules photoréceptrices des yeux des animaux et responsables de la perception de la lumière.
Structure et fonction de l'opsine[modifier | modifier le code]
L'opsine est une protéine membranaire possédant 7 hélices transmembranaires. Elle est liée à une apoprotéine dérivée de la vitamine A, le chromophore, qui peut être soit le 11-cis-retinal, soit le 11-cis-3,4-dehydroretinal. Dans l'opsine bovine, cette liaison se fait par la lysine 296, située dans la dernière hélice transmembranaire.
L'opsine modifie la longueur d'onde d'absorption du chromophore auquel elle est associée. De plus, une fois que l'opsine est activée par l'absorption d'un photon par le chromophore, elle est capable d'activer un second messager (souvent une protéine G) et déclencher une réponse cellulaire. L'opsine confère donc à la cellule une sensibilité à la lumière.
Opsines animales[modifier | modifier le code]
On distingue sept grandes sous-familles d'opsines chez les animaux, qui se sont différenciées avant la séparation entre les Protostomiens et les Deutérostomiens[3].
└─o
├─o Mélanopsines / Opsines couplées à Gq
└─o
├─o
│ ├─o Encephalopsines / tmt-opsines
│ │
│ └─o Opsines visuelles et non-Visuelles des vertébrés
└─o
├─o Opsines couplées à Go
└─o
├─o Neuropsines
└─o
├─o Peropsines
│
└─o Photoisomérases
Opsines des vertébrés[modifier | modifier le code]
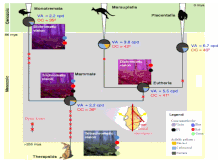
La sous-famille des opsines visuelles et non-visuelles des vertébrés s'est différenciée en 6 catégories bien distinctes, après l'individualisation de l'embranchement des vertébrés et avant la séparation en ordre distincts[5].
└─o Pigment ancestral des Vertébrés
├─o
│ ├─o Pigments P
│ │
│ └─o Pigments M/LWS
└─o
├─o Pigments SWS1
└─o
├─o Pigments SWS2
└─o
├─o Pigments RH2
│
└─o Pigments RH1
Les poissons présentent une adaptation de leur vision des couleurs avec leur environnement lumineux, passant du tétrachromatisme pour les espèces vivant dans les eaux peu profondes à la perte de la vision des couleurs pour les espèces des profondeurs. Les oiseaux, reptiles et thérapsides (« reptiles mammaliens ») jouissent pour la plupart d’une vision probablement tétrachromate (la couleur supplémentaire étant souvent celle des ultraviolets qui sont utilisés pour différents rôles, comme la sélection sexuelle, la communication ou la reconnaissance)[6], alors que la vision devient généralement dichromatique par perte d'opsine chez les mammifères aquatiques[7] et les mammifères nocturnes[8]. La plupart des mammifères actuels (bovidés, équidés, canidés, félidés, (singes du nouveau monde)) sont aujourd'hui considérés comme des dichromates, c'est-à-dire avec deux sortes de cônes seulement, mais quelques-uns (dont certains primates) sont trichromates[9].
Chez les primates, la perte de plusieurs gènes de récepteurs olfactifs associés à des opsines coïncide avec l'acquisition de gènes de photorécepteurs impliqués dans la vision trichromatique[10]. Chez ces animaux, la tendance évolutive vers la disparition du museau et la régression du prognathisme facial est liée à la réduction de l'appareil olfactif au profit du système tactile et visuel (adaptation à la vie arboricole diurne grâce à des mains et pieds préhensiles, développement d'aires visuelles assurant une vision binoculaire stéréoscopique et une meilleure coordination dans l'obscurité de la forêt[11]), et un trichromatisme lié à l'évolution d'un régime alimentaire exclusivement insectivore à un régime de plus en plus omnivore : fruits, jeunes pousses, noix, insectes présentant une taille et une consistance très variées, etc.)[12]. Cette vision trichromatique (vision rouge-vert supplémentaire) serait un avantage sélectif permettant de distinguer tout ce qui n'a pas la même couleur que celle d'un feuillage mature (fruits et jeunes pousses de la végétation)[13].
Chez les primates haplorrhiniens (Singes et humains), le gène codant le pigment visuel absorbant les longueurs d'onde moyennes donne naissance par duplication à deux gènes. Cette mutation génétique leur fait gagner une couleur mais aussi une acuité visuelle bien supérieure à celles des autres mammifères[14].
Les humains ont les protéines photoréceptrices suivantes :
- la rhodopsine qui s'exprime dans les bâtonnets (responsables de la vision nocturne) ;
- trois types d'opsines différentes qui s'expriment dans les cônes (responsables de la vision des couleurs) :
- l'opsine S (S pour « short » en anglais) ou bleue : maximum d'absorption à 420 nm ;
- l'opsine M (M pour « middle » en anglais) ou verte : maximum d'absorption à 530 nm ;
- l'opsine L (L pour « long » en anglais) ou rouge : maximum d'absorption à 560 nm.
Notes et références[modifier | modifier le code]
- (en) Palczewski K.-2000_, « Crystal structure of Rhodopsin: A G Protein-Coupled Receptor », Science, vol. 289, no 5480, , p. 739-745 (DOI 10.1126/science.289.5480.739).
- Findlay, « The opsin family of proteins », Biochem. J., vol. 238, , p. 625-642.
- (en) Terakita A., « The opsins », Genome biology, vol. 5, no 3, , p. 213.1-213.9 (DOI 10.1186/gb-2005-6-3-213, lire en ligne).
- (en) Rui Borges, Warren E. Johnson, Stephen J. O’Brien, Cidália Gomes, Christopher P. Heesy & Agostinho Antunes, « Adaptive genomic evolution of opsins reveals that early mammals flourished in nocturnal environments », BMC Genomics, vol. 19, no 1, , p. 21 (DOI 10.1017/S0952523805226159).
- S. Yokoyama, « Molecular Évolution Of Vertebrate Visual Pigments », Progress in Retinal and Eye Research, vol. 19, no 4, , p. 385-419.
- (en) Justin Marshall, Kentaro Arikawa, « Unconventional colour vision », Current Biology, vol. 24, no 24, , p. 1150-1154 (DOI 10.1016/j.cub.2014.10.025).
- (en) L. A. Newman, P. R. Robinson, « Cone visual pigments of aquatic mammals », Vis. Neurosci., vol. 22, no 6, , p. 873-879 (DOI 10.1017/S0952523805226159).
- (en) Jacobs G. H., Neitz M., Neitz J., « Mutations in S-cone pigment genes and the absence of colour vision in two species of nocturnal primate », Proc. R. Soc. Lond. B, vol. 263, no 1371, , p. 705–710 (DOI 10.1098/rspb.1996.0105).
- Rowe, Michael H (2002). "Trichromatic color vision in primates." News in Physiological Sciences. 17(3), 93-98.
- (en) Yoav Gilad, Victor Wiebe, Molly Przeworski, Doron Lancet, Svante Pääbo, « Loss of Olfactory Receptor Genes Coincides with the Acquisition of Full Trichromatic Vision in Primates », PLoS Biol, vol. 2, , p. 120-125 (DOI 10.1371/journal.pbio.0020005).
- La migration des orbites vers l'avant assure en outre une meilleure vision binoculaire stéréoscopique. Il existe cependant au sein des primates une grande variabilité sur le degré de convergence orbitale et la taille du champ binoculaire mais il semble que cette convergence et la vision binoculaire correspondent aux ancêtres des primates. Ces derniers étaient des insectivores avec cette vision adaptée pour mieux discerner le camouflage de leurs proies habitant un environnement nocturne. D'après (en) Callum F.Ross, « Allometric and functional influences on primate orbit orientation and the origins of the anthropoidea. J Hum Evol 29: », Journal of Human Evolution, vol. 29, no 3, , p. 201–227 (DOI 10.1006/jhev.1995.1057).
- Robert Boyd, Joan Silk, L'aventure humaine. Des molécules à la culture, De Boeck Supérieur, , p. 264.
- Sharpe et al. (2006). Advantages and disadvantages of human dichromacy. Journal of Vision, 6, 213-223. Retrieved from http://www.journalofvision.org/content/6/3/3.full.pdf+html
- (en) Kanwaljit S. Dulai, Miranda von Dornum, John D. Mollon & David M. Hunt, « Duplication in New World and Old World Primates », Genome Res., vol. 9, , p. 629-638 (DOI 10.1101/gr.9.7.629).
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (en) David M. Hunt, Mark W. Hankins, Shaun P Collin, N. Justin Marshall, Evolution of Visual and Non-visual Pigments, Springer, , 276 p. (lire en ligne)
