Chlorure d'oxalyle
| Chlorure d'oxalyle | |
| |
| Chlorure d'oxalyle | |
| Identification | |
|---|---|
| Nom UICPA | dichlorure d'éthanedioyle |
| No CAS | |
| No ECHA | 100.001.092 |
| No CE | 201-200-2 |
| SMILES | |
| Apparence | liquide incolore fumant, odeur pénétrante |
| Propriétés chimiques | |
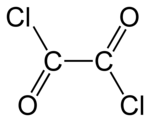
| Formule | C2Cl2O2 [Isomères] |
| Masse molaire[1] | 126,926 ± 0,006 g/mol C 18,93 %, Cl 55,86 %, O 25,21 %, |
| Propriétés physiques | |
| T° fusion | −16 °C |
| T° ébullition | 63 à 64 °C (1,017 bar) |
| Solubilité | Décomposition violente dans l'eau et l'alcool. Soluble dans l'éther diéthylique, le disulfure de carbone, le chloroforme, le tétrachlorure de carbone, le benzène |
| Masse volumique | 1,4785 |
| Propriétés optiques | |
| Indice de réfraction | 1,429 à 13 °C |
| Précautions | |
| SGH[2] | |
| H260, H314, H331, H335, EUH014, EUH029, P280, P301+P330+P331, P304+P340, P305+P351+P338, P308+P310 et P402+P404 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorure d'oxalyle est un composé chimique organique de formule (COCl)2. Il appartient à la famille des halogénures d'acyle, dérivé de l'acide oxalique, le plus simples des acides dicarboxyliques.
Synthèse
[modifier | modifier le code]Le chlorure d'oxalyle est préparé à partir de l'acide oxalique et du pentachlorure de phosphore (PCl5).
Utilisations
[modifier | modifier le code]Réactif d'oxydation
[modifier | modifier le code]Le chlorure d'oxalyle est un des réactifs utilisés pour l'oxydation de Swern, une oxydation douce des alcools en aldéhydes ou cétones.
Estérification
[modifier | modifier le code]Tout comme les autres chlorures d'acyles, le chlorure d'oxaylyle réagit avec les alcools pour produire des esters :
- 2 RCH2OH + (COCl)2 → RCH2OC(O)C(O)OCH2R + 2 HCl
Synthèse de chlorures d'acyle
[modifier | modifier le code]C'est un des réactifs permettant en synthèse organique de préparer des chlorures d'acyles à partir des acides carboxyliques correspondants. Comme avec le chlorure de thionyle SOCl2, la réaction est fortement favorisée par l'évaporation des produits qui sont gazeux aux pression et température normales :
- RCO2H + (COCl)2 → RCOCl + HCl + CO + CO2
Le chlorure d'oxalyle tend à être plus doux, plus sélectif que d'autres agents de chloration.
Réaction de Friedel-Crafts
[modifier | modifier le code]Le chlorure d'oxalyle réagit avec les cycles aromatiques comme le benzène en présence de chlorure d'aluminium en tant que catalyseur pour produire des chlorures d'acyle aromatiques, par réaction de Friedel-Crafts[3],[4]. Le chlorure d'acyle obtenu peut être hydrolysé pour former l'acide carboxylique correspondant.
Précautions
[modifier | modifier le code]Comme tous les halogénures d'acyle, le chlorure d'oxalyle réagit avec l'eau en libérant l'acide halohydrique correspondant, l'acide chlorhydrique. Ses effets sur la santé sont comparables à ceux du phosgène.
En , un Airbus A330 de Malaysia Airlines a été irrémédiablement endommagé après une fausse déclaration de marchandises : du chlorure d'oxalyle avait fui dans sa soute[5].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oxalyl_chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche de sécurité établie par Merck, datée du 04.07.19 (version 6.4)
- Neubert, M. E.; Fishel, D. L., Preparation of 4-Alkyl- and 4-Halobenzoyl Chlorides: 4-Pentylbenzoyl Chloride, Org. Synth., coll. « vol. 7 », , p. 420
- Sokol, P. E., Mesitoic Acid, Org. Synth., coll. « vol. 5 », , p. 706
- (en) « Firm told to pay $65 mln for ruining plane », Reuters, (consulté le )




