« Détresse respiratoire » : différence entre les versions
| Ligne 71 : | Ligne 71 : | ||
== Prise en charge == |
== Prise en charge == |
||
=== |
=== Oxygénothérapie === |
||
En raison du caractère d'urgence vitale de la détresse respiratoire, le traitement est débuté dès la phase pré-hospitalière<ref name=":0" />. Après s'être assuré de la liberté des voies aériennes supérieures, le premier traitement est l'oxygénothérapie |
En raison du caractère d'urgence vitale de la détresse respiratoire, le traitement est débuté dès la phase pré-hospitalière<ref name=":0" />. Après s'être assuré de la liberté des voies aériennes supérieures, le premier traitement à initier en urgence est l'oxygénothérapie<ref name=":7">{{Article |langue=en |prénom1=J.R. |nom1=Masclans |prénom2=P. |nom2=Pérez-Terán |prénom3=O. |nom3=Roca |titre=The role of high-flow oxygen therapy in acute respiratory failure |périodique=Medicina Intensiva (English Edition) |volume=39 |numéro=8 |date=2015-11 |doi=10.1016/j.medine.2015.05.004 |lire en ligne=https://linkinghub.elsevier.com/retrieve/pii/S2173572715000624 |consulté le=2019-12-26 |pages=505–515 }}</ref>. Celle-ci peut être réalisée de plusieurs manières<ref name=":7" /> : masque facial haute concentration, système de haut débit nasal type Optiflow... La prise en charge spécifique de la cause de la détresse respiratoire est fonction de l'étiologie de la détresse respiratoire. |
||
Le principal facteur limitant de l'oxygénothérapie au masque haute concentration est le débit d'oxygène. Si celui-ci peut atteindre 15 L/min, son efficacité clinique est toutefois limitée par les débits ventilatoires que le patient est capable de mobiliser<ref name=":7" />. En effet, le débit inspiratoire de pointe est supérieur au débit d'oxygène fourni, et le volume d'air inspiré est complété par l'air de la pièce. |
|||
La prise en charge spécifique de la cause de la détresse respiratoire est fonction de l'étiologie de la détresse respiratoire. |
|||
Les systèmes d'oxygénothérapie nasale à haut débit, jusqu'à 60 L/min, contournent cette limite particulière en permettant au patient de n'inspirer que le mélange gazeux délivré<ref name=":7" />. Ils sont adjoints d'un humidificateur et d'un réchauffeur permettant une meilleure tolérance du gaz délivré. Leurs canules nasales sont également mieux tolérées par les patients que les masques faciaux à haute concentration<ref name=":8">{{Article |langue=en |prénom1=J. J. |nom1=Ward |titre=High-Flow Oxygen Administration by Nasal Cannula for Adult and Perinatal Patients |périodique=Respiratory Care |volume=58 |numéro=1 |date=2013-01-01 |issn=0020-1324 |issn2=1943-3654 |doi=10.4187/respcare.01941 |lire en ligne=http://rc.rcjournal.com/cgi/doi/10.4187/respcare.01941 |consulté le=2019-12-26 |pages=98–122 }}</ref>. Ces systèmes ont été d'abord utilisés en pédiatrie, mais sont désormais étendus aux adultes<ref name=":9">{{Article |langue=en |prénom1=Dominic |nom1=Wilkinson |prénom2=Chad |nom2=Andersen |prénom3=Colm PF |nom3=O'Donnell |prénom4=Antonio G |nom4=De Paoli |titre=High flow nasal cannula for respiratory support in preterm infants |périodique=Cochrane Database of Systematic Reviews |date=2016-02-22 |doi=10.1002/14651858.CD006405.pub3 |lire en ligne=http://doi.wiley.com/10.1002/14651858.CD006405.pub3 |consulté le=2019-12-26 }}</ref>{{,}}<ref name=":8" />{{,}}<ref>{{Article |langue=en |prénom1=M. |nom1=Nishimura |titre=High-Flow Nasal Cannula Oxygen Therapy in Adults: Physiological Benefits, Indication, Clinical Benefits, and Adverse Effects |périodique=Respiratory Care |volume=61 |numéro=4 |date=2016-04-01 |issn=0020-1324 |issn2=1943-3654 |doi=10.4187/respcare.04577 |lire en ligne=http://rc.rcjournal.com/cgi/doi/10.4187/respcare.04577 |consulté le=2019-12-26 |pages=529–541 }}</ref>. Réservés aux patients possédant une activité ventilatoire spontanée suffisante, ils peuvent permettre d'éviter le passage à une authentique assistance ventilatoire<ref name=":7" />. Cependant, les nombreux biais des études réalisées chez l'adulte ne permettent pas d'évaluer l'efficacité du traitement par rapport à l'oxygénothérapie classique<ref>{{Article |langue=en |prénom1=Amanda |nom1=Corley |prénom2=Claire M |nom2=Rickard |prénom3=Leanne M |nom3=Aitken |prénom4=Amy |nom4=Johnston |titre=High-flow nasal cannulae for respiratory support in adult intensive care patients |périodique=Cochrane Database of Systematic Reviews |date=2017-05-30 |pmid=28555461 |pmcid=PMC6481761 |doi=10.1002/14651858.CD010172.pub2 |lire en ligne=http://doi.wiley.com/10.1002/14651858.CD010172.pub2 |consulté le=2019-12-26 }}</ref>. |
|||
=== Assistance ventilatoire === |
=== Assistance ventilatoire === |
||
| Ligne 95 : | Ligne 97 : | ||
Lorsqu'un patient est intubé, cette phase de sevrage ventilatoire peut être complexe. Une trachéotomie peut parfois être réalisée ; en diminuant le travail ventilatoire, elle facilite la tâche au patient. |
Lorsqu'un patient est intubé, cette phase de sevrage ventilatoire peut être complexe. Une trachéotomie peut parfois être réalisée ; en diminuant le travail ventilatoire, elle facilite la tâche au patient. |
||
Après l'extubation, un support par VNI peut être réalisé. Cela permet de diminuer le risque de nouvelle intubation<ref name=":3" />{{,}}<ref name=":6" />. Ceci est particulièrement intéressant chez les patients présentant des facteurs de risque d'échec d'extubation tels que l'hypercapnie, l'insuffisance cardiaque, et la toux inefficace<ref name=":6" />. |
Après l'extubation, un support par VNI peut être réalisé. Cela permet de diminuer le risque de nouvelle intubation<ref name=":3" />{{,}}<ref name=":6" />. Ceci est particulièrement intéressant chez les patients présentant des facteurs de risque d'échec d'extubation tels que l'hypercapnie, l'insuffisance cardiaque, et la toux inefficace<ref name=":6" />. La VNI est ensuite arrêtée lorsqu'il n'existe plus de signes cliniques ou gazométriques de défaillance respiratoire<ref name=":3" />{{,}}<ref name=":6" />. |
||
Il est aussi possible d'utiliser l'oxygénothérapie nasale à haut débit au lieu de la VNI après l'extubation<ref>{{Article |langue=en |prénom1=Yue-Nan |nom1=Ni |prénom2=Jian |nom2=Luo |prénom3=He |nom3=Yu |prénom4=Dan |nom4=Liu |titre=Can high-flow nasal cannula reduce the rate of reintubation in adult patients after extubation? A meta-analysis |périodique=BMC Pulmonary Medicine |volume=17 |numéro=1 |date=2017-12 |issn=1471-2466 |pmid=29149868 |pmcid=PMC5693546 |doi=10.1186/s12890-017-0491-6 |lire en ligne=https://bmcpulmmed.biomedcentral.com/articles/10.1186/s12890-017-0491-6 |consulté le=2019-12-26 |pages=142 }}</ref>, en particulier chez l'enfant et le prématuré<ref name=":9" />. |
|||
La VNI est ensuite arrêtée lorsqu'il n'existe plus de signes cliniques ou gazométriques de défaillance respiratoire<ref name=":3" />{{,}}<ref name=":6" />. |
|||
== Références == |
== Références == |
||
Version du 26 décembre 2019 à 16:47
| CISP-2 | R99 |
|---|---|
| CIM-10 | J96.0 |
| DiseasesDB | 6623 |
| eMedicine | 167981 |
| MeSH | D012131 |
La détresse respiratoire est une insuffisance respiratoire survenant de manière brutale[1]. C'est une urgence diagnostique et thérapeutique qui engage le pronostic vital du patient. Elle ne doit pas être confondue avec le syndrome de détresse respiratoire aiguë, qui est un œdème pulmonaire lésionnel.
Les causes les plus fréquentes sont l’œdème aigu du poumon d'origine cardiogénique et la décompensation respiratoire de l'insuffisant respiratoire chronique.
Épidémiologie
Une étude réalisée en 2002 auprès d'environ 1500 patients adultes admis en unité de réanimation dans 16 pays[2] a retrouvé que 32 % étaient admis pour une détresse respiratoire. Parmi les patients admis pour d'autres raisons, 35 % ont présenté une détresse respiratoire au cours de l'évolution de leur pathologie initiale. Au total, la mortalité globale est de 31 %.
Concernant les enfants, il s'agit d'un motif courant d'admission en réanimation pédiatrique ; la mortalité est de 24 à 34 %[3].
Définition et physiopathologie
Généralités
Une défaillance respiratoire aiguë survient lorsque le système respiratoire, de manière brutale, ne parvient plus à assurer les échanges gazeux de dioxygène et de dioxyde de carbone[4]. Elle est définie habituellement par l'analyse des gaz dissous dans le sang artériel. Une PaO2 inférieure à 60 mmHg (soit 8,0 kPa) est la valeur seuil retenue[4],[3].
On distingue deux grands types de détresse respiratoire[4] : l'insuffisance respiratoire hypoxémique, de type 1, et l'insuffisance respiratoire hypercapnique, de type 2.
L'insuffisance respiratoire hypoxémique peut survenir dans plusieurs circonstances entraînant une défaillance du poumon lui-même[4] : inadéquation du rapport ventilation/perfusion, apparition d'un effet shunt, altération de la diffusion alvéolo-capillaire, ou hypoventilation alvéolaire.
L'insuffisance respiratoire hypercapnique, elle, survient lors d'anomalies de la mécanique de la ventilation empêchant l'élimination du CO2. L'hypoxie est alors accompagnée d'une hypercapnie, définie par une PaCO2 supérieure à 45 mmHg (soit 6,0 kPa)[4], ce qui entraîne une acidose respiratoire avec un pH sanguin artériel inférieur à 7,35[3].
Certains[5] distinguent également les insuffisances respiratoires aiguës de type 3 (en contexte péri-opératoire) et 4 (survenant au cours d'un état de choc hémodynamique).
Cas particulier des enfants
Les enfants, en particulier les plus jeunes, sont plus susceptibles de présenter une détresse respiratoire que les adultes[3]. En effet, le calibre plus réduit de leurs voies respiratoires augmente la résistance à l'écoulement de l'air, et facilite l'obstruction bronchique par les sécrétions ou l’œdème. La moindre rigidité de leur paroi thoracique participe également à l'augmentation du travail ventilatoire. Le diaphragme et les muscles respiratoires accessoires contiennent moins de fibres musculaires lentes que ceux de l'adulte, ce qui facilite l'épuisement respiratoire. Enfin, les très jeunes enfants ont un système nerveux immature qui les prédispose à l'apnée et à la bradypnée.
Signes cliniques
Le diagnostic de détresse respiratoire est avant tout clinique, et peut être établi directement au lit du patient[3]. Le tableau clinique combine les conséquences directes de l'atteinte de l'appareil respiratoire, et les mesures de compensation mises en œuvre par l'organisme.
Les signes de lutte[1] sont dominés par la polypnée et le tirage des muscles respiratoires.
Les signes de gravité[1], aussi appelés signes de faillite, varient selon les organes atteints. Ils traduisent le retentissement global de la détresse respiratoire et indiquent le plus souvent la nécessité d'une assistance ventilatoire. Au plan respiratoire, la respiration abdominale paradoxale et la cyanose sont les signes majeurs. Cette dernière peut manquer en cas d'anémie majeure, si le taux d'hémoglobine est inférieur à 5 g·dl-1. Au plan neurologique, l'hypercapnie, lorsqu'elle est présente, entraîne un astérixis et des troubles de la vigilance et du comportement (agitation ou coma)[3]. Enfin, au plan circulatoire, le cœur pulmonaire aigu est une défaillance cardiaque droite. Il est accompagné d'un pouls paradoxal, et peut s'associer à une défaillance cardiovasculaire allant jusqu'à l'état de choc.
Lorsqu'une hypercapnie est présente[1], le tableau peut se compléter de sueurs abondantes.
Les patients, adultes comme enfants, porteurs de maladies neuromusculaires, peuvent présenter peu de signes cliniques[3] ; dans ces populations, la détresse respiratoire doit être facilement évoquée et une gazométrie artérielle réalisée.
Examens complémentaires
Peu d'examens complémentaires sont nécessaires à l'établissement du diagnostic[3]. Dans l'urgence, la radiographie thoracique et la gazométrie sanguine artérielle sont les seuls examens requis par l'algorithme diagnostic[1]. Au besoin, d'autres examens seront demandés selon la cause de la détresse et son évolution (électrocardiogramme, TDM thoracique, fibroscopie bronchique avec lavage broncho-alvéolaire, analyse des crachats...), mais ils ne doivent pas retarder la mise en route du traitement.
Étiologies

Chez l'adulte
Les causes de détresse respiratoire sont nombreuses[1]. Le diagnostic étiologique repose sur l'examen clinique, complété de la radiographie thoracique et de l'analyse de la gazométrie artérielle[3].
La première étape diagnostique est la vérification de la liberté des voies aériennes supérieures. Ce diagnostic est clinique. L'inhalation d'un corps étranger est la cause la plus fréquente chez l'enfant et la personne âgée souffrant de troubles de déglutition, mais toute obstruction laryngée ou trachéale est susceptible d'être en cause. Une sténose trachéale serrée, un œdème de Quincke ou une tumeur du larynx peuvent ainsi être impliquées.
Lorsque les voies aériennes sont libres, la radiographie pulmonaire et l'auscultation permettent de diagnostiquer les atteintes de la plèvre et du parenchyme pulmonaire. Au niveau pleural, tout épanchement de grande abondance (pneumothorax ou épanchement liquidien) est susceptible d'entraîner une détresse respiratoire. Le traitement en est alors le drainage rapide. Au niveau pulmonaire, une atélectasie est l'absence de ventilation d'un territoire plus ou moins important, souvent par obstruction mécanique. Les pneumopathies, en particulier bactériennes, touchant un volume pulmonaire important sont une cause fréquente de détresse respiratoire, de même que l’œdème pulmonaire, qu'il soit d'origine cardiaque (œdème aigu du poumon) ou lésionnelle (syndrome de détresse respiratoire aiguë). Enfin, les atteintes des pneumopathies interstitielles peuvent être à l'origine de la détresse respiratoire.
Lorsque la radiographie et l'examen clinique sont peu contributifs, la gazométrie artérielle permet d'orienter le diagnostic[4]. La normalité de la capnie (quantité de CO2) et du pH oriente vers une embolie pulmonaire ou un asthme aigu grave. L'embolie sera recherchée par un TDM thoracique ; l'examen clinique peut être très frustre, mais également comporter des signes d'insuffisance cardiaque droite et de cœur pulmonaire aigu, en particulier en cas d'embolie massive et proximale. Dans ce cas, le traitement sera l'anticoagulation ou la fibrinolyse. L'asthme aigu grave sera, lui, traité par des bronchodilatateurs. Lorsque la gazométrie retrouve une acidose respiratoire, qui se manifeste par une élévation de la capnie et des bicarbonates, la détresse respiratoire résulte généralement de l'acutisation d'une pathologie chronique. Il s'agit le plus souvent de l'exacerbation d'une BPCO. Les atteintes neuromusculaires comme la myasthénie ou un syndrome de Guillain-Barré peuvent être en cause. La poliomyélite était une cause fréquente jusqu'à l'introduction du vaccin ; la ventilation pulmonaire des patients était alors assurée, passée la phase aiguë, par un poumon d'acier. Enfin, les atteintes pariétales peuvent également être responsables d'une détresse respiratoire. Les fractures multiples de côtes peuvent être en cause, en particulier chez les patients dont l'état ventilatoire de base est précaire. Les myopathies, qu'elles soient congénitales ou acquises, sont également parfois en cause, par une atteinte des muscles inspiratoires. Dans le cas de ces maladies chroniques, il faut rechercher l'élément ayant causé la décompensation : surinfection bronchique, embolie pulmonaire, pneumopathie, chirurgie thoracique ou insuffisance cardiaque gauche peuvent alors être également en cause.
Chez l'enfant
Chez le nouveau-né proche du terme, la cause la plus fréquente de défaillance respiratoire est le SDRA, pour 43 % des patients, suivi de l'inhalation de méconium (9,7 %) et de la pneumopathie ou du sepsis (8,3 %)[7]. La tachypnée transitoire du nouveau-né n'est impliquée que dans 4 % des cas.
Prise en charge
Oxygénothérapie
En raison du caractère d'urgence vitale de la détresse respiratoire, le traitement est débuté dès la phase pré-hospitalière[1]. Après s'être assuré de la liberté des voies aériennes supérieures, le premier traitement à initier en urgence est l'oxygénothérapie[8]. Celle-ci peut être réalisée de plusieurs manières[8] : masque facial haute concentration, système de haut débit nasal type Optiflow... La prise en charge spécifique de la cause de la détresse respiratoire est fonction de l'étiologie de la détresse respiratoire.
Le principal facteur limitant de l'oxygénothérapie au masque haute concentration est le débit d'oxygène. Si celui-ci peut atteindre 15 L/min, son efficacité clinique est toutefois limitée par les débits ventilatoires que le patient est capable de mobiliser[8]. En effet, le débit inspiratoire de pointe est supérieur au débit d'oxygène fourni, et le volume d'air inspiré est complété par l'air de la pièce.
Les systèmes d'oxygénothérapie nasale à haut débit, jusqu'à 60 L/min, contournent cette limite particulière en permettant au patient de n'inspirer que le mélange gazeux délivré[8]. Ils sont adjoints d'un humidificateur et d'un réchauffeur permettant une meilleure tolérance du gaz délivré. Leurs canules nasales sont également mieux tolérées par les patients que les masques faciaux à haute concentration[9]. Ces systèmes ont été d'abord utilisés en pédiatrie, mais sont désormais étendus aux adultes[10],[9],[11]. Réservés aux patients possédant une activité ventilatoire spontanée suffisante, ils peuvent permettre d'éviter le passage à une authentique assistance ventilatoire[8]. Cependant, les nombreux biais des études réalisées chez l'adulte ne permettent pas d'évaluer l'efficacité du traitement par rapport à l'oxygénothérapie classique[12].
Assistance ventilatoire
Une assistance ventilatoire[1] est nécessaire lorsque la sévérité de la détresse respiratoire engage le pronostic vital, et que l'on observe un ou plusieurs signes de défaillance. Elle peut également être mise en route sur des critères gazométriques d'hypoxémie résistant à l'oxygénothérapie, ou d'acidose respiratoire (pH sanguin artériel < 7,35) causée par une hypercapnie.
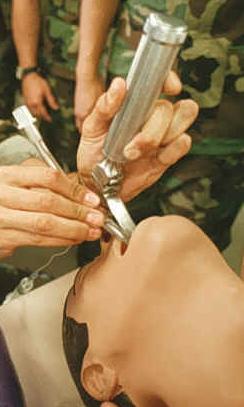
L'assistance ventilatoire peut être réalisée de deux manières : ventilation non invasive et intubation trachéale[1].
La ventilation non invasive (VNI) comprend toutes les méthodes d'assistance ventilatoire mécanique n'ayant pas recours à l'abord endotrachéale, où un masque naso-buccal apporte de l'air sous pression positive. En soulageant la charge de travail des muscles du thorax, elle évite l'épuisement respiratoire[13]. La pression expiratoire positive qu'elle délivre permet également le recrutement des alvéoles pulmonaires[14]. La VNI est réservée aux défaillances respiratoires isolées chez des patients coopérants, et doit être débutée de manière précoce, sans attendre l'installation de l'acidose[14],[15]. L'intérêt majeur des techniques de VNI est d'éviter les complications de l'intubation, en particulier les pneumopathies nosocomiales acquises sous respirateur, et d'aider à rétablir une mécanique ventilatoire physiologique[4],[14]. Le taux d'échec, défini par la nécessité d'une intubation trachéale, est faible. Dans le SDRA, l'utilisation de la VNI évite environ 50 % des intubations[16]. La VNI est recommandée en première intention dans les décompensations de BPCO, où elle permet de réduire de 65 % le nombre d'intubations, et de diminuer la mortalité de 46 %[13]. Dans l'œdème aigu du poumon, la VNI permet de réduire le risque relatif de mortalité intrahospitalière, le taux d'intubation, et la durée de séjour[17]. Elle est également d'une grande utilité dans la gestion des traumatismes fermés du thorax avec une importante réduction de mortalité (3 % contre 22 %[16]). En ce qui concerne les pathologies neuromusculaires, la VNI est souvent utilisée, mais le manque d'études randomisées limite la possibilité de recommandations[18]. Son utilisation dans l'asthme est, elle, controversée[19]. La VNI possède cependant une fonction préventive en post-opératoire après chirurgie abdominale sus-mésocolique, où elle permet de diminuer le nombre d'intubations[20]. Son utilisation préventive en chirurgie thoracique est elle peu prouvée[21].
L'utilisation d'une sédation légère afin d'améliorer la tolérance de la VNI, en particulier chez le nouveau-né, est délicate en raison du caractère dépresseur respiratoire des médicaments utilisés[16],[22]. L'absence de nécessité de sédation, contrairement à l'intubation, est d'ailleurs considérée comme l'un des avantages de la technique[13]. Plusieurs facteurs de risque d'échec de la VNI ont été identifiés[13] : asynchronisme entre le patient et la machine, claustrophobie, présence de médicaments dépresseurs respiratoires, et manque d'habitude des équipes de soin.
Lorsque la ventilation non invasive n'est pas possible, ou qu'elle ne permet pas d'amélioration du patient, une intubation trachéale est nécessaire. La réévaluation de la VNI doit être précoce, 1 à 2 heures après sa mise en route, afin de ne pas retarder une intubation devenue nécessaire[15].
Si malgré tout l'assistance ventilatoire ne permet pas d'assurer une oxygénation et une décarboxylation correctes, une ECMO peut être mise en route. Le plus souvent, il s'agit d'une ECMO veino-veineuse.
Sevrage ventilatoire
Une fois l'épisode aigu passé, l'assistance ventilatoire doit être retirée.
Lorsqu'un patient est intubé, cette phase de sevrage ventilatoire peut être complexe. Une trachéotomie peut parfois être réalisée ; en diminuant le travail ventilatoire, elle facilite la tâche au patient.
Après l'extubation, un support par VNI peut être réalisé. Cela permet de diminuer le risque de nouvelle intubation[16],[15]. Ceci est particulièrement intéressant chez les patients présentant des facteurs de risque d'échec d'extubation tels que l'hypercapnie, l'insuffisance cardiaque, et la toux inefficace[15]. La VNI est ensuite arrêtée lorsqu'il n'existe plus de signes cliniques ou gazométriques de défaillance respiratoire[16],[15].
Il est aussi possible d'utiliser l'oxygénothérapie nasale à haut débit au lieu de la VNI après l'extubation[23], en particulier chez l'enfant et le prématuré[10].
Références
- Collège des enseignants de pneumologie, « Détresse respiratoire de l'adulte »
- (en) Jean-Louis Vincent, Serdar Akça, Arnaldo de Mendonça et Philip Haji-Michael, « The Epidemiology of Acute Respiratory Failure in Critically Ill Patients », Chest, vol. 121, no 5, , p. 1602–1609 (DOI 10.1378/chest.121.5.1602, lire en ligne, consulté le )
- (en) Matthew L. Friedman et Mara E. Nitu, « Acute Respiratory Failure in Children », Pediatric Annals, vol. 47, no 7, , e268–e273 (ISSN 1938-2359, DOI 10.3928/19382359-20180625-01, lire en ligne, consulté le )
- (en) C. Roussos et A. Koutsoukou, « Respiratory failure », European Respiratory Journal, vol. 22, no Supplement 47, , p. 3s–14s (ISSN 0903-1936 et 1399-3003, DOI 10.1183/09031936.03.00038503, lire en ligne, consulté le )
- (en) Bishwajit Bhattacharya et Kimberly Davis, « Assessment and Management of Acute Respiratory Distress in the ICU », dans Surgical Critical Care Therapy, Springer International Publishing, (ISBN 978-3-319-71711-1, DOI 10.1007/978-3-319-71712-8_15, lire en ligne), p. 161–169
- Collègue des enseignants de pneumologie, « Détresse respiratoire de l'adulte »,
- (en) Giacomo Bellani, John G. Laffey, Tài Pham et Eddy Fan, « Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries », JAMA, vol. 315, no 8, , p. 788 (ISSN 0098-7484, DOI 10.1001/jama.2016.0291, lire en ligne, consulté le )
- (en) J.R. Masclans, P. Pérez-Terán et O. Roca, « The role of high-flow oxygen therapy in acute respiratory failure », Medicina Intensiva (English Edition), vol. 39, no 8, , p. 505–515 (DOI 10.1016/j.medine.2015.05.004, lire en ligne, consulté le )
- (en) J. J. Ward, « High-Flow Oxygen Administration by Nasal Cannula for Adult and Perinatal Patients », Respiratory Care, vol. 58, no 1, , p. 98–122 (ISSN 0020-1324 et 1943-3654, DOI 10.4187/respcare.01941, lire en ligne, consulté le )
- (en) Dominic Wilkinson, Chad Andersen, Colm PF O'Donnell et Antonio G De Paoli, « High flow nasal cannula for respiratory support in preterm infants », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD006405.pub3, lire en ligne, consulté le )
- (en) M. Nishimura, « High-Flow Nasal Cannula Oxygen Therapy in Adults: Physiological Benefits, Indication, Clinical Benefits, and Adverse Effects », Respiratory Care, vol. 61, no 4, , p. 529–541 (ISSN 0020-1324 et 1943-3654, DOI 10.4187/respcare.04577, lire en ligne, consulté le )
- (en) Amanda Corley, Claire M Rickard, Leanne M Aitken et Amy Johnston, « High-flow nasal cannulae for respiratory support in adult intensive care patients », Cochrane Database of Systematic Reviews, (PMID 28555461, PMCID PMC6481761, DOI 10.1002/14651858.CD010172.pub2, lire en ligne, consulté le )
- (en) Christian R Osadnik, Vanessa S Tee, Kristin V Carson-Chahhoud et Joanna Picot, « Non-invasive ventilation for the management of acute hypercapnic respiratory failure due to exacerbation of chronic obstructive pulmonary disease », Cochrane Database of Systematic Reviews, (PMID 28702957, PMCID PMC6483555, DOI 10.1002/14651858.CD004104.pub4, lire en ligne, consulté le )
- Giuseppe Bello, Paolo De Santis et Massimo Antonelli, « Non-invasive ventilation in cardiogenic pulmonary edema », Annals of Translational Medicine, vol. 6, no 18, , p. 355–355 (PMID 30370282, PMCID PMC6186545, DOI 10.21037/atm.2018.04.39, lire en ligne, consulté le )
- (en) D. R. Hess, « Noninvasive Ventilation for Acute Respiratory Failure », Respiratory Care, vol. 58, no 6, , p. 950–972 (ISSN 0020-1324 et 1943-3654, DOI 10.4187/respcare.02319, lire en ligne, consulté le )
- (en) Josep Masip et Arantxa Mas, « Noninvasive ventilation in acute respiratory failure », International Journal of Chronic Obstructive Pulmonary Disease, , p. 837 (ISSN 1178-2005, PMID 25143721, PMCID PMC4136955, DOI 10.2147/COPD.S42664, lire en ligne, consulté le )
- (en) Nicolas Berbenetz, Yongjun Wang, James Brown et Charlotte Godfrey, « Non-invasive positive pressure ventilation (CPAP or bilevel NPPV) for cardiogenic pulmonary oedema », Cochrane Database of Systematic Reviews, (PMID 30950507, PMCID PMC6449889, DOI 10.1002/14651858.CD005351.pub4, lire en ligne, consulté le )
- (en) Fang Luo, Djillali Annane, David Orlikowski et Li He, « Invasive versus non-invasive ventilation for acute respiratory failure in neuromuscular disease and chest wall disorders », Cochrane Database of Systematic Reviews, (PMID 29199768, PMCID PMC6486162, DOI 10.1002/14651858.CD008380.pub2, lire en ligne, consulté le )
- (en) Wei Jie Lim, Redhuan Mohammed Akram, Kristin V Carson et Satya Mysore, « Non-invasive positive pressure ventilation for treatment of respiratory failure due to severe acute exacerbations of asthma », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD004360.pub4, lire en ligne, consulté le )
- (en) Debora AS Faria, Edina MK da Silva, Álvaro N Atallah et Flávia MR Vital, « Noninvasive positive pressure ventilation for acute respiratory failure following upper abdominal surgery », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD009134.pub2, lire en ligne, consulté le )
- (en) Maria FS Torres, Gustavo JM Porfírio, Alan PV Carvalho et Rachel Riera, « Non-invasive positive pressure ventilation for prevention of complications after pulmonary resection in lung cancer patients », Cochrane Database of Systematic Reviews, (PMID 30840317, PMCID PMC6402531, DOI 10.1002/14651858.CD010355.pub3, lire en ligne, consulté le )
- (en) Roberto Bellù, Koert A de Waal et Rinaldo Zanini, « Opioids for neonates receiving mechanical ventilation », Cochrane Database of Systematic Reviews, (DOI 10.1002/14651858.CD004212.pub3, lire en ligne, consulté le )
- (en) Yue-Nan Ni, Jian Luo, He Yu et Dan Liu, « Can high-flow nasal cannula reduce the rate of reintubation in adult patients after extubation? A meta-analysis », BMC Pulmonary Medicine, vol. 17, no 1, , p. 142 (ISSN 1471-2466, PMID 29149868, PMCID PMC5693546, DOI 10.1186/s12890-017-0491-6, lire en ligne, consulté le )