Macroalgue
l'appellation « Macroalgue » s'applique en français à plusieurs taxons distincts.
Taxons concernés
Voir texteLes macroalgues sont des algues multicellulaires visibles à l'œil nu qui vivent principalement dans les milieux aquatiques, notamment les océans, les mers, et certains cours d'eau. Elles forment un groupe extrêmement diversifié de près de 25 000 espèces décrites[1] (environ 45 % d'algues rouges, 30 % d'algues brunes et 25 % d'algues vertes), aux propriétés bioactives et morphologies variées (allant de formes filamenteuses simples jusqu'à des formes plus complexes)[2].
Contribution à la production primaire des écosystèmes côtiers
[modifier | modifier le code]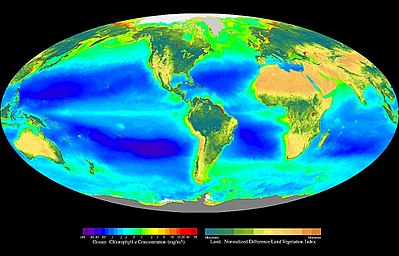
Les macroalgues jouent un rôle majeur dans le fonctionnement des écosystèmes côtiers du plateau continental. Les écologues marins estiment que la production primaire des macroalgues benthiques côtières représente 5 à 10 % de la production océanique globale (contre 90 à 95 % pour le phytoplancton[4] qui constitue la base de la chaîne alimentaire aquatique), alors la surface des zones côtières correspond à 7 % de l'océan mondial[5].
Par leur production primaire, elles peuvent séquestrer environ 175 millions de tonnes de carbone chaque année sous forme de carbone organique dissous et particulaire, soit en l'enfouissant dans les sédiments côtiers, soit en l'exportant vers les profondeurs marines[6],[7]. Ce potentiel suscite des études documentant l'intérêt de l'algoculture dans la lutte contre le changement climatique[8],[9].
La production primaire algale (macroalgues benthiques et épiphytiques mais aussi microalgues benthiques, épiphytiques et planctoniques) constitue une source de nourriture importante pour de nombreux représentants de la faune (poissons herbivores, oursins, crustacés tels que crabes omnivores, amphipodes et isopodes, gastéropodes tels que les patelles, littorines, gibbules, aplysies et ormeaux dont le microbiote digestif varie en fonction du type de régime algal)[10], en se positionnant à la base de la chaîne alimentaire côtière[11].
|
Exploitation
[modifier | modifier le code]L'exploitation des goémons comme engrais remonte au moins au haut Moyen Âge. Elle a contribué pour une part importante à la réputation de la « ceinture dorée » de la Bretagne[14]. Leur premier usage industriel a lieu au XVIe siècle dans les manufactures du verre et les fabriques de savon. La soude « naturelle » nécessaire à la réaction de saponification est en effet obtenue à partir des cendres de certaines plantes riches en sodium comme la Soude brûlée, les salicornes ou les algues. La température de fusion de la silice est abaissée par le carbonate de soude issue des cendres de bois mais avec l'épuisement des forêts, les verriers utilisent les cendres obtenues par le brûlage des algues brunes. Cette exploitation des algues décline avec la production industrielle du carbonate de sodium au XIXe siècle trois siècles plus tard mais en 1811, le chimiste Bernard Courtois découvre l'iode dans ces mêmes cendres, ce qui marque la deuxième période industrielle des algues. Les pains de soude de goémoniers sont livrés aux usines qui en extraient l'iode utilisé dans l'industrie de la photographie (iodure d'argent) et le domaine médical (teinture d'iode désinfectant les blessures externes)[15]. Aujourd'hui, des vestiges de cette époque sont encore visibles : ruines de fours à goémon et d'anciennes usines d'extraction d'iode
En raison de leur grande diversité chimique et de la bioactivité de leurs métabolites secondaires[16], les macroalgues présentent un intérêt commercial qui est surtout exploité depuis le XXe siècle : cosmétiques, industrie agroalimentaire (légumes, phycocolloïdes : épaississant, gélifiant, etc.), horticulture (plastique compostable), agriculture (engrais et substitut aux phytosanitaires chimiques), santé humaine (médicaments) et animale (substitut aux antibiotiques), bioénergie. Cet intérêt peut être une des causes de leur régression (ou extinction localement due à leur surexploitation) mais il peut également être valorisé à travers une filière algues bien maîtrisée.
La production mondiale de macro-algues (récolte et surtout culture d'algues brunes, rouges et vertes) explose au XXIe siècle : de 15 millions de tonnes en 2009[17], elle est passée à 25 millions de tonnes en 2016 (24 millions étant issues de l'algoculture). La Chine est le premier producteur mondial (64 % de la production mondiale) devant l'Indonésie (11 %) et l'Europe (1 % dont la France à peine 0,3 %)[18].
Filière macroalgues
[modifier | modifier le code]La filière macroalgues rassemble producteurs (récoltants à pied, pêcheurs, algoculteurs), les transformateurs, les fournisseurs de technologie, les organismes de recherche, les collectivités locales, les organismes locaux pertinents et autres parties prenantes.
Par exemple, la filière algues bretonne rassemble 1 500 chercheurs, génère 1 700 emplois avec près de 80 entreprises de transformation et de commercialisation (groupe Roullier, Goëmar…), pour une valeur estimée à 424 M€ en 2015[19].
Notes et références
[modifier | modifier le code]- Plus de 800 espèces ont été recensées sur les côtes de l'Atlantique nord européen. Cf Jacqueline Cabioc'h, Alain Le Toquin, Jean-Yves Floc'h, Guide des algues des mers d'Europe, Delachaux et Niestlé, , p. 31. En France, la plus grande richesse floristique se rencontre en Bretagne qui possède le plus vaste champ d'algues d'Europe : 10 millions de tonnes de ressources avec quelque 700 espèces identifiées. Cf Gérard Thomas, « Les moissonneurs de la mer de Lanildut. Le port breton produit de mai à octobre quelque 30.000 tonnes de goémon », sur liberation.fr,
- (en) Nick Robinson, Pia Winberg & Lisa Kirkendale, « Genetic improvement of macroalgae: status to date and needs for the future », Journal of Applied Phycology, vol. 25, no 3, , p. 703–716 (DOI 10.1007/s10811-012-9950-x).
- (en) C. B. Field, M. J. Behrenfeld, J. T. Randerson et P. Falkowski, « Primary production of the biosphere: integrating terrestrial and oceanic components », Science, vol. 281, no 5374, , p. 237-240.
- La photosynthèse du phytoplancton représente environ la moitié de la production primaire globale annuelle de la biosphère. Cf (en) C.B. Field, M.J. Behrenfeld , J.T. Randerson , P. Falkowski, « Primary production of the biosphere: integrating terrestrial and oceanic components », Science, vol. 281, no 5374, , p. 237-240 (DOI 10.1126/science.281.5374.237).
- (en) Roland Wollast, « The coastal organic carbon cycle : Fluxes, Sources, and sinks », dans R. F. C. Mantoura, Jean-Marie Martin, R. Wollast, Ocean Margin Processes in Global Change, Wiley, , p. 365–381
- (en) Dorte Krause-Jensen & Carlos M. Duarte, « Substantial role of macroalgae in marine carbon sequestration », Nature Geoscience, vol. 9, no 10, , p. 737-742 (DOI 10.1038/ngeo2790).
- Schéma montrant les principales oies de séquestration du carbone des macroalgues.
- (en) Carlos M. Duarte, Jiaping Wu, Xi Xiao, Annette Bruhn, Dorte Krause-Jensen, « Can Seaweed Farming Play a Role in Climate Change Mitigation and Adaptation? », Frontiers in Marine Science, vol. 4, (DOI 10.3389/fmars.2017.00100).
- (en) Halley E. Froehlich, Jamie C. Afflerbach, Melanie Frazier, Benjamin S. Halpern, « Blue Growth Potential to Mitigate Climate Change through Seaweed Offsetting », Current Biology, vol. 29, no 18, , p. 3087-3093 (DOI 10.1016/j.cub.2019.07.041).
- (en) A. Gobet, L. Mest, M. Perennou, S. Dittami, C. Caralp, C. Coulombet, S. Huchette, S. Roussel, G. Michel, C. Leblanc, « Seasonal and algal diet-driven patterns of the digestive microbiota of the European abalone Haliotis tuberculata, a generalist marine herbivore », Microbiome, vol. 6, no 60, (DOI 10.1186/s40168-018-0430-7).
- (en) Robert Edward Lee, Phycology, Cambridge University Press, (lire en ligne), p. 3
- (en) David C. Watson, Trevor A. Norton, « The habitat and feeding preferences of Littorina obtusata (L.) and L. mariae sacchi et rastelli », Journal of Experimental Marine Biology and Ecology, vol. 112, no 1, , p. 61-72 (DOI 10.1016/S0022-0981(87)80015-1).
- David Busti, « Défenses des algues brunes face au broutage par la Littorine obtuse. Auteur et publication », sur ens-lyon.fr, .
- Jacqueline Cabioc'h, Jean-Yves Floc'h, Alain Le Toquin, Charles François Boudouresque, Alexandre Meinesz, Marc Verlaque, Guide des algues des mers d'Europe, Delachaux et Niestlé, , p. 24.
- Carole Dougoud Chavannes, Les algues de A à Z, Jouvence, , p. 24.
- (en) Stengel DB, Connan S, Popper ZA., « Algal chemodiversity and bioactivity: sources of natural variability and implications for commercial application », Biotechnol Adv., vol. 29, no 5, , p. 483-501 (DOI 10.1016/j.biotechadv.2011.05.016).
- Lucile Mesnildrey, Céline Jacob, Katia Frangoudes, Mélanie Reunavot, Marie Lesueur, La filière des macro-algues en France. Rapport d’étude. NETALGAE - Interreg IVb, 2012, p.3
- (en) S. Thanigaivel, Natarajan, Chandrasekaran, Amitava Mukherjee, John Thomas, « Seaweeds as an alternative therapeutic source for aquatic disease management », Aquaculture, vol. 464, , p. 529-536 (DOI 10.1016/j.aquaculture.2016.08.001).
- Denis Sergent, « Dans le Finistère, des pionniers misent sur les algues », sur la-croix.com, .
Annexes
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) David M. John, Gabriel K. Ameka, George W. Lawson, The marine macroalgae of the tropical West Africa sub-region, Cramer, Berlin, 2003, 217 p. (ISBN 9783443510473)



