Lutéoline
| Lutéoline | |
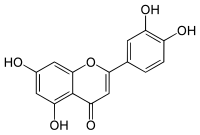
| |
| Identification | |
|---|---|
| Nom UICPA | 5,7-dihydroxy-2-(3,4-dihydroxyphényl)-chromèn-4-one |
| Synonymes |
Lutéolol |
| No CAS | |
| No ECHA | 100.007.038 |
| No CE | 207-741-0 |
| SMILES | |
| InChI | |
| Apparence | solide jaune pâle |
| Propriétés chimiques | |
| Formule | C15H10O6 [Isomères] |
| Masse molaire[1] | 286,236 3 ± 0,014 5 g/mol C 62,94 %, H 3,52 %, O 33,54 %, |
| Propriétés physiques | |
| T° fusion | 329,5 °C[2] |
| Solubilité | 388 mg·L-1 (eau, 25 °C)[2] |
| Pression de vapeur saturante | 6,27×10-12 mmHg (25 °C)[2] |
| Précautions | |
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 180 mg·kg-1 (souris, i.p.)[3] |
| LogP | 2,53[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La lutéoline ou lutéolol est un composé chimique de la famille des flavonoïdes, et plus spécifiquement l'une des flavones les plus communes[4]. Elle fut isolée pour la première fois par le chimiste français Michel-Eugène Chevreul à partir de la gaude (autre nom du réséda des teinturiers, une plante utilisée autrefois pour fabriquer de la teinture jaune).
Occurrence naturelle
[modifier | modifier le code]La lutéoline est principalement présente dans les feuilles du réséda des teinturiers, mais elle est aussi présente dans le céleri, le thym, le pissenlit, l'écorce de fruits ou d'arbres, les fleurs de trèfle, et le pollen des Ambroisies[4]. Elle a aussi été isolée à partir de la Salvia tomentosa[5].
Dans l'alimentation, on la trouve dans le céleri, le poivron vert, le thym, la perilla, la camomille, les carottes, l'huile d'olive, la menthe poivrée, le romarin et l'origan[6],[7], la margose[8].
Propriétés biomédicales
[modifier | modifier le code]On prête à la lutéoline un grand rôle dans le corps humain, comme antioxydant, destructeur de radicaux libres, agent préventif d'inflammation, comme composé aidant au métabolisme des glucides, et comme régulateur du système immunitaire. Ces caractéristiques laissent à penser qu'elle joue aussi un rôle important dans la prévention du cancer. De nombreuses recherches expérimentales décrivent la lutéoline comme un agent chimique qui réduit considérablement les inflammations[9] et les symptômes du choc septique.
Effets indésirables
[modifier | modifier le code]La lutéoline est un inhibiteur de la PDE-4[10].
Elle peut provoquer des effets indésirables gastro-intestinaux tels que des nausées, des vomissements et ou une hypersécrétion gastrique, effets qui doivent être surveillés attentivement chaque fois qu'elle est prescrite pour traiter des allergies, de l'asthme ou une broncho-pneumopathie chronique obstructive.
Teinture
[modifier | modifier le code]La lutéoline peut aussi servir de teinture jaune. Elle est notamment présente dans la gaude qui sert depuis le Moyen Âge à teindre les tissus en jaune, teinture considérée comme l'une des meilleures. La gaude fut d'ailleurs surnommée « herbe des juifs », car c'est l'une des plantes utilisée, du XIIIe siècle au XVIIIe siècle, par les juifs du Comtat Venaissin (qui était alors un domaine pontifical) pour teindre en jaune les chapeaux qu'ils étaient tenus de porter comme signe distinctif.
Hétérosides
[modifier | modifier le code]Comme la plupart des flavonoïdes, la lutéoline est présente dans la nature sous forme d'hétérosides. On peut citer parmi eux:
- l'orientine, son 8-C glucoside
- l'isoorientine, son 6-C glucoside
- la lutéoline-7-glucoside (cynaroside) et la Lutéoline-7-diglucoside présente dans la fausse chicorée (« café de pissenlit »)
- la lutéoline-7-rutinoside (véronicastroside).
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Lutéoline », sur ChemIDplus
- Yaoxue Tongbao. Bulletin of Pharmacology. Vol. 16(2), Pg. 11, 1981.
- (en) John Mann, Secondary Metabolism (2nd. ed.), Oxford, UK, Oxford University Press, , 2e éd., 374 p., poche (ISBN 978-0-19-855529-2, LCCN 86005390), p. 279–280
- (en) A. Ulubelen, M. Miski, P. Neuman, and T. J. Mabry, « Flavonoids of Salvia tomentosa (Labiatae) », Journal of Natural Products, vol. 42, no 4, , p. 261–263 (DOI 10.1021/np50003a002)
- (en) Kayoko Shimoi, Hisae Okada, Michiyo Furugori, Toshinao Goda, Sachiko Takase, Masayuki Suzuki, Yukihiko Hara, Hiroyo Yamamoto, Naohide Kinae, « Intestinal absorption of luteolin and luteolin 7-O-[beta]-glucoside in rats and humans », FEBS Letters, vol. 438, no 3, , p. 220–224 (DOI 10.1016/S0014-5793(98)01304-0)
- (en) López-Lázaro M., « Distribution and biological activities of the flavonoid luteolin », Mini Rev Med Chem., vol. 9, no 1, , p. 31–59 (PMID 19149659)
- Seyed Mohammad Hosein Hosseini Adarmanabadi, Orod Jalali Khalil Abadi, Amirhossein Amiri et Rozhina Tamannaeifar, « Pharmacotherapeutic Potential of Bitter Gourd (Momordica charantia) in Age-related Neurological Diseases », Journal of Integrative Neuroscience, vol. 23, no 4, , p. 86 (ISSN 0219-6352, DOI 10.31083/j.jin2304086, lire en ligne, consulté le )
- Luteolin reduces IL-6 production in microglia by inhibiting JNK phosphorylation and activation of AP-1 — PNAS
- Eur J Pharmacol. 2009 Oct 22. [Epub ahead of print] Luteolin, a non-selective competitive inhibitor of phosphodiesterases 1-5, displaced [(3)H]-rolipram from high-affinity rolipram binding sites and reversed xylazine/ketamine-induced anesthesia. Yu MC, Chen JH, Lai CY, Han CY, Ko WC.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Luteolin » (voir la liste des auteurs).

