Cochliomyia
| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Classe | Insecta |
| Ordre | Diptera |
| Famille | Calliphoridae |
Cochliomyia est un genre de diptères de la famille des Calliphoridae dont les espèces sont connues sous le nom de « mouches à viande ». Il est représenté par quatre espèces, C. macellaria, C. hominivorax, C. aldrichi et C. minima.
L'espèce C. hominivorax est qualifiée d'« asticot à viande » primaire parce que ses larves, qui provoquent des myiases, se nourrissent de tissus vivants. Cette alimentation cause des lésions cutanées profondes en forme de poche, qui peuvent être très dommageables pour l'animal hôte. C. macellaria , aldrichi et minima sont appelés « asticots à viande » secondaires car leurs larves produisent aussi des myiases, mais se nourrissent uniquement de tissus nécrotiques. C. hominivorax, la Lucilie bouchère, et C. macellaria prospèrent dans les zones tropicales chaudes d'Amérique, les deux autres espèces étant cantonnées aux Caraïbes. C hominivorax a été accidentellement introduite en Afrique du Nord puis entièrement éradiquée.
En anglais, les Cochliomyia sont appelés « New World screwworm flies » (« Ver-à-vis du Nouveau Monde ») pour les distinguer des « Old World screwworm flies » (« Vers-à-vis de l'Ancien Monde »).
Description[modifier | modifier le code]
C. macellaria, C. hominivorax sont les deux principaux représentants du genre et les plus étudiés. C. aldrichi et C. minima, uniquement présentent dans les Antilles ont suscité moins d'intérêt.
En 2014 une première étude phylogénétique complète conclue à la validité du genre, et indique que C. aldrichi et C. minima se seraient différenciées à partir d'un ancêtre commun arrivé initialement dans les îles caraïbéennes[1].
Une meilleure description des différents stades larvaires présente un intérêt particulier en médecine légale[1].
Imago[modifier | modifier le code]

Comme tous les diptères, Chochliomyia a trois régions corporelles (tête, thorax et abdomen), trois paires de pattes, une paire d'ailes antérieures utilisées pour le vol, une paire de licols, ailes postérieures modifiées, et une paire d'antennes.
Ces espèces partagent de nombreuses caractéristiques avec la Mouche domestique. Notamment, comme toutes les espèces de la famille des Calliphoridae, elles ont des poils sur leurs mérones, des aristas plumeuses et des calyptères bien développés.
C. macellaria et C. hominivorax sont toutes deux vert métallique à vert bleuâtre en coloration majeure, avec des soies sur la surface dorsale de la veine de la tige, des gena orange, des stigmates antérieurs blanc pâle, des palpes filiformes et trois bandes longitudinales noires ( vittae ) sur le notum du thorax. L'espèce C. macellaria a des sétules pâles sur la plaque fronto-orbitale à l'extérieur de la rangée de poils frontaux, tandis que C. hominivorax a ses sétules sombres sur la plaque fronto-orbitale à l'extérieur de la rangée de poils frontaux. La femelle C. macellaria a un basicoste jaunâtre tandis que la femelle C. hominivorax a un basicoste brun. C. macellaria est longue de 6 à 9 mm tandis que C. hominivorax mesure de 8 à 10 mm de long[2],[3].
Larves[modifier | modifier le code]
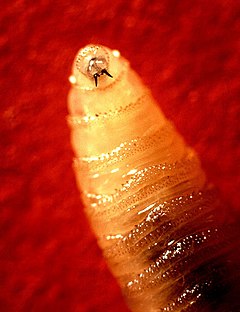
Les larves de C. macellaria et de C. hominivorax ont des corps cylindriques effilés vers l'avant avec au moins dix épines robustes autour de la zone spiraculaire, des péritrèmes incomplets, un bouton indistinct ou absent et des bandes de petites épines sur chaque segment. Les larves de C. hominivorax ont des troncs trachéaux nettement pigmentés. Les larves de C. macellaria n'ont pas de troncs trachéaux pigmentés; ils ont des épines en forme de V sur la protubérance anale et pas de sclérite buccale. Au troisième stade larvaire, les deux espèces peuvent atteindre une longueur de 17 mm[2],[4].
L'aspect des larves explique leur nom vernaculaire en anglais de « Screw-Worm » (« Ver-à-vis »), car elles possèdent de petites épines sur chaque segment du corps qui ressemblent à des filets de vis.
Cycle de la vie[modifier | modifier le code]
Le cycle de vie général de Cochliomyia est similaire à celui de tous les autres diptères en ce sens qu'ils sont holométaboles. Les quatre stades sont l'œuf, la larve, la nymphe et l'adulte ou imago.
Un cycle de vie complet dure en moyenne 21 jours dans les conditions optimales d'un environnement chaud et humide, mais peut durer jusqu'à trois mois sous des climats plus froids. Une seule fois dans leur vie, les femelles pondent de 100 à 400 œufs qu'elles déposent généralement au bord d'une plaie ouverte. Les zones nasales, orales ou anales de l'hôte sont particulièrement sujettes à la ponte de Cochliomyia.
Les larves éclosent environ 12 à 21 heures après la ponte des œufs. Elles sont de couleur crème. Les larves de C. hominivorax plongent la tête la première dans la source de nourriture la plus proche et s'enfouissent plus profondément, mangeant de la chair vivante si disponible. Il en résulte une lésion en forme de poche qui provoque une douleur intense chez l'hôte. Les larves de C. macellaria ne se nourrissent que du tissu nécrotique d'une plaie.
Après cinq à sept jours, les larves tombent et s'éloignent de la source de nourriture pour se nymphoser. Les larves s'enfouissent dans la première couche de terre végétale, sous les feuilles ou les ordures, et commencent leur nymphose. La nymphe est de couleur brun foncé. Cette étape peut durer de sept jours à une température chaude jusqu'à deux mois si le temps est beaucoup plus froid.
Les adultes émergent et passent un jour ou deux à finir leur maturité.
Distribution[modifier | modifier le code]
Les deux principales espèces prospèrent dans les zones tropicales chaudes et humides. C. macellaria est l'espèce la plus commune des deux en Amérique du Nord, répartie dans le Nord de l'Amérique du Sud, l'Amérique centrale, les îles des Caraïbes, les États-Unis et le Sud du Canada.
C. hominivorax était distribué dans le Nord de l'Amérique du Sud, en Amérique centrale, dans les îles des Caraïbes et aux États-Unis avant l'utilisation de la technique des insectes stériles, après quoi il a été éliminé des États-Unis et du Mexique. Cependant, les pays limitrophes d'Amérique centrale relèvent le défi de maintenir l'élimination de l'espèce puisque ces pays ont encore des populations de cette mouche. Bon nombre de ces pays continuent de mettre en œuvre des programmes d'élimination[2],[3].
C. aldrichi et C minima sont en revanche endémiques des seules Antilles[1].
Systématique[modifier | modifier le code]
Le nom valide complet (avec auteur) de ce taxon est Cochliomyia Townsend, 1915[5].
Liste des espèces[modifier | modifier le code]
Selon GBIF (25 février 2023)[6]:
- Cochliomyia aldrichi Del Ponte, 1938
- Cochliomyia hominivorax (Coquerel, 1858)
- Cochliomyia macellaria (Fabricius, 1775)
- Cochliomyia minima Shannon, 1926
- Cochliomyia violacea Macquart, 1843
Le genre Cochliomyia et l'humain[modifier | modifier le code]
Cochliomyia hominivorax[modifier | modifier le code]
Biologie[modifier | modifier le code]
La Lucilie bouchère, C. hominivorax, est une espèce parasite, dont les larves sont réputées pour manger et infester la chair d'organismes vivants, principalement des animaux à sang chaud tels que les bovins et autres animaux d'élevage.
Leurs larves provoquent une myiase, une infestation d'asticots dans les lésions ou autres blessures que l'animal hôte peut avoir. Une attaque de mouches peut avoir lieu lors de procédés agricoles tels que le marquage, la castration, l'écornage et la queue des animaux hôtes. Ces procédés, ainsi que les coupures provoquées par le fil de fer barbelé des clôtures et les piqûres de puces, entraînent une myiase chez l'hôte. Les nombrils des nouveau-nés peuvent également être sites d'infestation[7]. C. hominivorax a tendance à se reproduire uniquement sur la chair d'un hôte vivant. Contrairement à la plupart des autres larves, elles attaquent et consomment des tissus vivants sains ainsi que des tissus en décomposition (l'épithète spécifique hominivorax se traduit littéralement par « mangeur d'hommes »).
Après l'éclosion des larves, celles-ci plongent dans la plaie et s'enfouissent plus profondément, perpendiculairement à la surface de la peau, mangeant de la chair vivante, ressemblant à nouveau à une vis enfoncée dans un objet. Les larves continuent alors à se nourrir des fluides de la plaie et des tissus de l'animal[8].
Les adultes de C. hominivorax ne se reproduisent qu'une seule fois dans leur vie. Les adultes sexuellement matures se reproduisent 3 à 4 jours après avoir émergé de la pupe. Les mâles mûrissent rapidement et passent leur temps à attendre et à manger la végétation voisine et le nectar des fleurs. Les femelles, cependant, sont prédatrices et se nourrissent des fluides des blessures vivantes. Les femelles peuvent voler sur de longues distances pour trouver un compagnon. Les mouches adultes de cette espèce vivent environ deux à trois semaines[8],[9].
Programmes d'éradication[modifier | modifier le code]


La technique de l'insecte stérile a été proposée par les scientifiques Edward F. Knipling et Raymond C. Bushland, et a été rapidement adoptée par le Département de l'agriculture des États-Unis en 1958. La technique est centrée sur un handicap reproducteur unique qui empêche les mouches femelles C. hominivorax de s'accoupler plus d'une fois. Les scientifiques ont ainsi pu prévoir que s'il était possible de stériliser cliniquement et de libérer un grand nombre de mâles à l'approche de la période de reproduction, les mâles fertiles pourraient être surpassés et que la majorité des mouches femelles pondraient des œufs stériles. L'irradiation des mâles a été utilisée pour la stérilisation.
Parce que l'industrie agricole perdait des millions de dollars par an en raison du traitement et de la perte d'animaux frappés, cette solution a été rapidement approuvée pour les tests.
Elle a été appliqué pour la première fois à grande échelle en Floride dans les années 1950, en raison à la fois de la gravité du problème sur place et de la géographie particulière de l'État, en quasi-presqu'île, qui a permis un isolement relatif de cette population de C. hominivorax en Floride.
L'éradication de la population primaire de Lucilie bouchère en Floride s'est achevée en 1959.
Le programme a ensuite été appliqué dans tout le Sud des États-Unis et finalement adopté dans une grande partie du Mexique en 1972 et dans certaines parties de l'Amérique centrale et du Sud. La Lucilie bouchère a été complètement éradiquée du Sud des États-Unis en 1966 et du Mexique en 1991.
Cependant, le bétail y est toujours vulnérable et des règles strictes concernant l'inspection des animaux et le signalement des infestations présumées sont toujours en vigueur[10].
Une nouvelle infestation de vers à vis dans les Florida Keys a été signalée pour la première fois en octobre 2016, principalement dans la population clé de cerfs, ainsi que cinq infestations confirmées chez des animaux domestiques. En réponse, l'USDA a relâché plus de 80 millions de mouches stériles à partir de 25 sites de lâcher au sol sur douze îles et la ville de Marathon[11].
La première infestation documentée de myiase à C. hominivorax en dehors des Amériques, et à ce jour la plus importante, s'est produite en Afrique du Nord de 1989 à 1991. L'épidémie a été attribuée à un troupeau de moutons dans la région de Tripoli en Libye, qui a commencé à subir des attaques de vers à vis en juillet 1989 ; au cours des mois suivants, la myiase s'est propagée rapidement, infectant de nombreux troupeaux sur une superficie de 25 000 km2. Finalement, la région infestée s'étendait de la côte méditerranéenne au désert du Sahara, menaçant les plus de 2,7 millions d'animaux sensibles à C. hominivorax qui habitaient la région. Plus de 14 000 cas de myiase à grande échelle dus à l'espèce C. hominivorax ont été documentés. Les méthodes de contrôle traditionnelles utilisant l'évaluation vétérinaire et le traitement des animaux individuels étaient insuffisantes pour contenir l'épidémie largement dispersée, de sorte que l'Organisation des Nations Unies pour l'alimentation et l'agriculture a lancé un programme basé sur la technique des insectes stériles[12]. Environ 1,26 milliard de mouches stériles ont été produites au Mexique, expédiées vers la zone infestée et relâchées pour s'accoupler avec leurs homologues sauvages. En quelques mois, la population de C. hominivorax s'est effondrée ; en avril 1991, le programme avait réussi à éradiquer C. hominivorax dans l'hémisphère oriental. Cet effort, qui a coûté moins de 100 millions de dollars, a été l'un des programmes internationaux de santé animale les plus efficaces et les plus réussis de l'histoire des Nations unies[8],[13].
L'épidémie nord-africaine a à la fois fourni la preuve de l'efficacité de la technique du mâle stérile et conduit à de nombreuses améliorations dans sa mise en œuvre ; après 1991, il est entré en service dans certaines parties de l'Amérique centrale et du Sud. Cependant, l'inaccessibilité de certaines zones habitées par la mouche, les différences linguistiques et la nécessité d'une vigilance constante ont ralenti l'éradication de cette espèce.
Recherches en cours[modifier | modifier le code]
Des recherches sont actuellement en cours pour développer un appât odorant synthétique pour remplacer l'utilisation d'animaux blessés comme appât, méthode autrefois utilisée et tombée en désuétude.
L'appât synthétique est formulé pour imiter le liquide de plaie naturel des animaux. Les mouches femelles sont attirées par les blessures des animaux pour obtenir un repas protéique et pour pondre. L'appât synthétique pourrait être utilisé dans les stations de recherche qui surveillent les mouches dans les régions où elles sont éradiquées et pour aider à réduire les populations de vers à vis dans les régions infestées[14].
Cochliomyia macellaria[modifier | modifier le code]
Description[modifier | modifier le code]
C. macellaria est une mouche carnivore dont les larves ne consomment que du tissu nécrotique, soit celui de la charogne, soit celui d'un hôte animal ou humain (myiase). Cette distinction importante entre C. macellaria et C. hominivorax n'a pas été comprise pendant une grande partie des antécédents médicaux ; la myiase des humains et des animaux était considérée comme universellement désastreuse. Cependant, au fur et à mesure que la compréhension médicale du processus de dégradation des tissus et d'infection progressait, on a commencé à observer que les plaies présentant des types spécifiques d'infestation par les asticots avaient en fait une gravité et une durée d'infection réduites. Cela a progressé au point où les larves de C. macellaria ont été appliquées dans certains cas comme asticots chirurgicaux. Cependant, la connotation négative entourant le mot "ver à vis" a persisté, et les vers à vis secondaires largement inoffensifs sont souvent accusés d'attaques myiasiques dont les vers à vis primaires sont en fait responsables. Cela ne doit pas être interprété comme signifiant que C. macellaria n'est pas un consommateur avide de chair ; il est régulièrement parmi les premiers colonisateurs de charognes et, dans les affaires médico-légales, a depuis longtemps l'habitude de littéralement consommer des preuves. Les vers à vis secondaires sont particulièrement abondants sur les cadavres et les charognes dans les zones chaudes et directement ensoleillées. Heureusement, avec l'avènement récent des preuves moléculaires, les asticots de C. macellaria retirés d'un corps et bouillis jusqu'à stérilité peuvent désormais fournir des informations vitales concernant une victime et déterminer un intervalle post mortem. Les entomologistes médico-légaux peuvent ainsi utiliser diverses méthodes d'extraction pour tester la composition du tube digestif des larves afin de déterminer si les victimes présentaient des traces de drogues ou de substances psychotropes dans leur organisme avant d'être tuées. Il est important, cependant, pour les entomologistes médico-légaux de déterminer si le ver à vis de l'Ancien Monde, Chrysomya rufifacies, est présent dans les masses d'asticots sur le corps, car C. rufifacies arrive généralement après C. macellaria dans la succession de colonisation d'un corps et ses larves des deuxième et troisième stades peuvent être prédatrices des larves de C. macellaria. Cela pourrait entraîner un intervalle post mortem décalé de quelques jours au plus si les larves de C. rufifacies devaient s'attaquer à toutes les larves de C. macellaria[9],[15],[16].
Les vers à vis secondaires ont le corps vert métallique stéréotypé du genre et les larves sont extrêmement similaires à celles de C. hominivorax. Le moyen le plus efficace de différencier les deux est de noter l'absence sur C. macellaria des tubes trachéaux pigmentés distinctifs, ainsi que la présence d'un motif d'épines en forme de « V » sur la protubérance anale et l'absence de sclérite buccale[2].
Histoire[modifier | modifier le code]
L'interaction entre les humains et C. macellaria en dehors de la myiase secondaire accidentelle a été en grande partie banale, à l'exception notable de leur utilisation précoce dans le traitement chirurgical des asticots. Cependant, étant donné la stigmatisation médicale entourant la mouche à vis et le faible potentiel même pour C. macellaria d'infester secondairement les tissus au-delà de l'étendue souhaitée de l'utilisation médicale, elle est actuellement tombée en disgrâce auprès de la communauté médicale, qui préfère le prévisible Lucilia sericata. Néanmoins, C. macellaria a été et demeure une préoccupation pour les agriculteurs, les vétérinaires et les responsables de la santé publique[17],[18].
Gestion humaine[modifier | modifier le code]

Les vers à vis primaires sont des parasites primaires obligatoires au stade larvaire, et par conséquent sont capables, contrairement aux vers à vis secondaires, d'initialiser la pénétration de la barrière cutanée pour créer une plaie d'entrée. Malgré cela, ils sont le plus souvent considérés comme des colonisateurs de plaies déjà existantes et sont fréquemment éclos à partir d'œufs pondus sur le périmètre d'une plaie. Une fois que l'infestation commence, un écoulement brun foncé ou brun rougeâtre commence à s'écouler de la plaie, parfois accompagné d'une odeur désagréable lorsque la chair commence à se décomposer. C'est souvent le premier signe chez le bétail et les victimes humaines que quelque chose ne va pas, et initie souvent une consultation avec un professionnel. Au fur et à mesure que l'infestation augmente, la victime commence à ressentir une irritation croissante des tissus et, dans le cas des animaux domestiques, on peut observer qu'elle devient renfermée, apathique et anorexique[8].
Une fois que le processus de diagnostic clinique commence et que la myiase est reconnue, les larves sont assez faciles à identifier. La structure globale de leur corps ressemble à la forme de vis en spirale sur laquelle leur nom commun est basé, une forme assez inhabituelle chez les larves parasites. L'extrémité crânienne des larves a deux crochets fortement incurvés, généralement de couleur sombre, et des motifs distinctifs de spiracle sont observés à l'extrémité caudale. Les caractéristiques les plus identifiables et le moyen le plus simple de différencier C. hominivorax et C. macellaria, sont les tubes trachéaux foncés proéminents qui sont visibles dans le dernier tiers du corps larvaire du premier, et sont souvent visibles à la fois avec un microscope et à l’œil nu[8].
Le traitement de la victime peut prendre du temps et, en raison de l'incidence élevée d'infection secondaire, être frustrant, mais avec un traitement décisif, un résultat étonnamment positif est souvent obtenu dans tous les cas sauf les pires. La première étape évidente est l'élimination manuelle des asticots, généralement à l'aide d'une pince à épiler ou d'une pince pour saisir la larve à l'extrémité postérieure lorsque les spiracles émergent pour permettre la respiration. Une fois que toutes les larves ont été retirées, un frottis antibiotique topique est appliqué, souvent accompagné d'un antibiotique oral. Le tissu nécrotique peut devoir être débridé, ce qui peut être un processus douloureux. Un pansement lâche est essentiel pour permettre un drainage continu du liquide de la plaie[8].
Comme pour beaucoup de choses, la prévention est le meilleur remède. Toute plaie ouverte, même si petite qu'une ampoule, est un site d'infestation potentiel et doit être traitée en conséquence avec des pesticides approuvés. Aux périodes de l'année où le bétail est le plus vulnérable (castration, mise bas, etc.), des inspections quotidiennes doivent être effectuées lorsque cela est possible. Les infestations détectées tôt sont tout à fait traitables, mais les décès peuvent résulter d'une infestation avancée, en particulier chez les moutons et les veaux nouveau-nés[8] .
Les vers à vis secondaires n'apparaissent qu'autour d'une plaie existante (la plaie étant dans ce cas définie comme incluant la zone du cordon ouvert du bétail nouveau-né), alors pratiquez la myiase facultative. Ils sont plus fortement attirés par les plaies infectées en raison de la forte odeur de l'écoulement de la plaie, mais même une petite cloque ou une abrasion peut servir de site d'infestation. Les mouches peuvent également être amenées à pondre leurs œufs dans des poils ou de la laine qui sont épais et tachés de tout fluide corporel[9].
Comme pour C. hominivorax, le premier signe d'infestation est souvent la surface irritée de la plaie, produisant bon nombre des mêmes symptômes. Les larves peuvent être diagnostiquées et identifiées par un professionnel qualifié en fonction de la taille, de la forme des larves (encore une fois en suivant la forme de la vis en spirale) et, finalement, du motif du spiracle. Ces larves n'ont pas les tubes trachéaux pigmentés distinctifs qui marquent C. hominivorax[9].
Comme le ver à vis secondaire n'a pas la caractéristique biologique d'une reproduction à vie unique comme le fait C. hominivorax, aucune méthode de contrôle généralisée n'est actuellement en place au-delà de la pulvérisation habituelle de pesticides effectuée pour le contrôle général des mouches. Cependant, en raison de son association avec la myiase facultative, son impact sur le bétail aux États-Unis n'est pas aussi grave. Il peut également être associé à une infestation humaine dans des établissements médicaux mal gérés et des zones frappées par la pauvreté, la vigilance est donc essentielle.
Publication originale[modifier | modifier le code]
- (en) Charles H. T. Townsend, « A new generic name for the screw-worm fly », Journal of the Washington Academy of Sciences, Washington, Washington Academy of Sciences (d), vol. 5, no 4, , p. 644-646 (ISSN 0043-0439 et 2573-2110, OCLC 1769417, JSTOR 24520917, lire en ligne)
Liens externes[modifier | modifier le code]
- (en) Référence Animal Diversity Web : Cochliomyia (consulté le )
- (en) Référence BioLib : Cochliomyia Townsend, 1915 (consulté le )
- (en) Référence Catalogue of Life : Cochliomyia (consulté le )
- (fr + en) Référence EOL : Cochliomyia (consulté le )
- (fr + en) Référence GBIF : Cochliomyia Townsend, 1915 (consulté le )
- (fr) Référence INPN : Cochliomyia Townsend, 1915 (TAXREF) (consulté le )
- (en) Référence IRMNG : Cochliomyia Townsend, 1915 (consulté le )
- (fr + en) Référence ITIS : Cochliomyia (consulté le )
- (en) Référence NCBI : Cochliomyia (taxons inclus) (consulté le )
- (en) Référence OEPP : Cochliomyia (consulté le )
- (en) Référence Paleobiology Database : Cochliomyia (consulté le )
- (en) Référence Taxonomicon : Cochliomyia Townsend, 1915 (consulté le )
- (en) Référence WoRMS : Cochliomyia Townsend, 1915 (+ liste espèces) (consulté le )
- Identification des espèces de calliphoridés
- Informations générales sur les vers à vis
- Cartographie des vers à vis du nouveau monde, Service d'inspection de la santé animale et végétale du Département de l'agriculture des États-Unis
- ver à vis secondaire Cochliomyia macellaria sur le site Web UF / IFAS Featured Creatures
- Profil d'espèce - Ver à vis ( Cochliomyia ), Centre national d'information sur les espèces envahissantes, Bibliothèque nationale de l'agriculture des États-Unis . Répertorie les informations générales et les ressources pour Screwworm.
- Dossiers du programme d'éradication des vers à vis de l'USDA, Bibliothèque nationale agricole de l'USDA. La bibliothèque possède une grande collection liée à l'éradication des vers à vis, y compris des papiers personnels d'individus impliqués dans le programme
- STOP aux vers à vis : sélections de la collection d'éradication des vers à vis, exposition en ligne de la Bibliothèque nationale agricole de l'USDA
- Ressources relatives au vivant :
Notes et références[modifier | modifier le code]
- (en) Sohath Yusseff-Vanegas et Ingi Agnarsson, « Molecular phylogeny of the forensically important genus Cochliomyia (Diptera: Calliphoridae) », ZooKeys, vol. 609, , p. 107–120 (ISSN 1313-2970, DOI 10.3897/zookeys.609.8638, lire en ligne, consulté le )
- Richardson, Betty T. "The Genus CALLITROGA Brauer." Workers in Subjects Pertaining to Agriculture in Land-Grant Colleges and Experiment Stations. Misc. Pub. 625. 1947.
- Terry Whitworth, « Keys to the Genera and Species of Blow Flies (Diptera: Calliphoridae) of America North of Mexico », Proceedings of the Entomological Society of Washington, vol. 108, no 3, , p. 689–725 (lire en ligne)
- Stojanovich, Chester J., Harry D. Pratt, Elwin E. Bennington.
- Townsend 1915, p. 99
- GBIF Secretariat. GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei accessed via GBIF.org, consulté le 25 février 2023
- (en) James E. Novy, « Screwworm control and eradication in the southern United States of America »
- "Cochliomyia Hominivorax"" Merck Veterinary Manual, Merck and Co., Inc. 2006.
- "Facultative Myiasis-producing Flies".
- Flores, Alfredo.
- Florida Trend, « APHIS Confirms New World Screwworm in Miami-Dade County, Florida », Trend Magazines, (lire en ligne, consulté le )
- D. A. Lindquist et M. Abusowa, « The new world screwworm in North Africa », FAO (consulté le )
- V Kouba, « History of the screwworm (Cochliomyia hominivorax) eradication in the Eastern Hemisphere », Historia medicinae veterinariae, vol. 29, no 2, , p. 43–53 (PMID 15376361)
- A. Cork et M. J. R. Hall, « Development of an odour-baited target for female New World screwworm, Cochliomyia hominivorax: Studies with host baits and synthetic wound fluids », Medical and Veterinary Entomology, vol. 21, no 1, , p. 85–92 (PMID 17373950, DOI 10.1111/j.1365-2915.2006.00661.x, S2CID 28769510)
- Gupta, A. et Setia, P., « Forensic Entomology - Past, Present and Future », Anil Aggrawal's Internet Journal of Forensic Medicine and Toxicology, vol. 5, no 1, , p. 50–53 (lire en ligne [archive du ], consulté le )
- Jeffrey D. Wells et Bernard Greenberg, « Rates of Predation By Chrysomya rufifacies (Macquart) on Cochliomyia macellaria (Fabr.) (Diptera: Calliphoridae) In the Laboratory: Effect of Predator and Prey Development », Pan-Pacific Entomologist, vol. 68, no 1, , p. 12–4
- R. A. Sherman, M. J. R. Hall et S. Thomas, « Medicinal Maggots: An Ancient Remedy for Some Contemporary Afflictions », Annual Review of Entomology, vol. 45, , p. 55–81 (PMID 10761570, DOI 10.1146/annurev.ento.45.1.55)
- Alyson Bexfield, A. Elizabeth Bond, Emily C. Roberts et Edward Dudley, « The antibacterial activity against MRSA strains and other bacteria of a <500Da fraction from maggot excretions/secretions of Lucilia sericata (Diptera: Calliphoridae) », Microbes and Infection, vol. 10, no 4, , p. 325–33 (PMID 18400544, DOI 10.1016/j.micinf.2007.12.011)
Bibliographie[modifier | modifier le code]
- Hall, David G.. Les mouches à viande d'Amérique du Nord. 1948.
- « mouche volante ». Encyclopædia Britannica. 2008. Encyclopædia Britannica Online. Récupéré le 19 mars 2008.
- Agent de santé animale (in. "Le ver du Nouveau Monde au Mexique et en Amérique centrale." FAO. Com. 1991. Récupéré le 19 mars 2008.
- "La bataille sans fin de l'Amérique contre les vers mangeurs de chair", par Sarah Zhang, The Atlantic, mai 2020.