Électrolyte
Un électrolyte est une substance conductrice, car elle contient des ions mobiles. Il existe des électrolytes liquides et solides. Les électrolytes liquides sont les électrolytes aqueux dans lesquels les ions proviennent d'un sel soluble et les sels fondus qui ne sont constitués que d'ions. Les électrolytes solides sont des cristaux dans lesquels certains ions sont mobiles ou des polymères comme ceux utilisés dans les membranes échangeuses d'ions.
Par exemple : le sel de table (chlorure de sodium, NaCl) qui se dissocie en ions, lorsque solubilisé dans l’eau. Une substance non-électrolyte ne conduit pas le courant électrique une fois dissoute dans l’eau. Par exemple : le sucre (comme le glucose) ne se dissocie pas en ions une fois solubilisé dans l’eau. Un courant est ainsi généré lorsqu’une charge est en mouvement. Traditionnellement l’électricité est générée par le mouvement des électrons. Le même principe s’applique ici, mais au lieu d’avoir des électrons en mouvement, ce sont les ions d'une solution.
Une solution électrolytique est une solution contenant des ions. Elle conduit le courant et est électriquement neutre.
Une solution électrolytique aqueuse est obtenue en dissolvant une substance appelée soluté dans de l'eau ; une solution électrolytique organique est une solution conductrice qui contient des molécules carbonées et différents minéraux.
Historique
C'est le phénomène de dissociation électrolytique, dont la théorie a été formulée par Svante August Arrhenius en 1887 puis perfectionnée par Peter Debye et Erich Hückel, qui explique la conductibilité électrolytique. Cette théorie fut complétée par Gilbert Newton Lewis.
Ions et composés ioniques
Les atomes et les molécules sont électriquement neutres, mais ils peuvent être transformés en particules chargées électriquement appelées ions. Ces ions proviennent d’une substance dissoute dans l’eau qui s'est dissociée en cation(s) et en anion(s).
Dissociation électrolytique des substances en solution
Un électrolyte faible est une substance qui se dissocie partiellement dans l’eau. La solution elle-même porte le nom d’électrolyte faible. Les acides faibles, comme l’acide acétique dont seulement environ 1 % des molécules se dissocient dans l’eau pour former des ions, sont des électrolytes faibles puisqu’ils ne sont pas totalement ionisés. Il y a aussi quelques sels qui forment des électrolytes faibles, comme le chlorure de mercure (II), puisqu’il ne s’ionise que partiellement en solution aqueuse.
Contrairement à un électrolyte faible, l’électrolyte fort s’ionise (se dissocie) presque totalement dans l’eau. La solution elle-même porte le nom d’électrolyte fort.
La différence entre un électrolyte fort et un électrolyte faible se rapporte donc au degré de dissociation des substances dissoutes dans l’eau.
Le tableau suivant présente les différentes familles d'électrolyte[1] :
| Électrolytes forts | Électrolytes faibles | |
|---|---|---|
| Acides | Acides forts : Inorganique : acide perchlorique (HClO4), acide nitrique (HNO3), acide sulfurique (H2SO4), acide chlorhydrique (HCl), acide bromhydrique (HBr) acide iodhydrique (HI), acide chlorique (HClO3), acide bromique (HBrO3) |
Acides faibles : Beaucoup d'inorganiques : acide sulfureux (H2SO3), acide carbonique (H2CO3), acide borique (H3BO3), acide sulfhydrique (H2S La plupart des organiques |
| Bases | Bases fortes : Inorganiques : Hydroxydes alcalins et hydroxydes alcalino-terreux |
Bases faibles : Ammoniac La plupart des organiques |
| Sel | La plupart | Bromures, iodures, cyanures Thiocyanates de mercure, zinc et cadmium |
Conductivité électrique
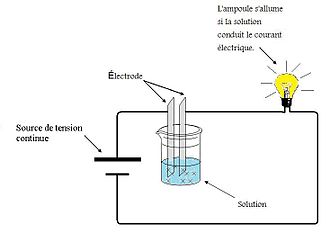
L’image représente un appareil qui sert à démontrer la conductivité électrique des solutions. En utilisant cet appareil, on peut démontrer que les solutions aqueuses de certaines substances sont conductrices ou non d’électricité. Il s’agit de placer deux électrodes dans une solution x. Lorsque le circuit est fermé, la lumière reste éteinte si la solution ne conduit pas le courant et elle s’allume si elle laisse passer le courant. L’intensité lumineuse varie en fonction de la force de l’électrolyte.
Électrolytes naturels
Certains électrolytes sont dits naturels. En effet, certains électrolytes sont présents dans le réseau sanguin. On parle alors d’électrolytes sanguins. D'autres sont présents dans la sueur, car elle contient des éléments électrolytiques, comme le potassium. Les électrolytes jouent un rôle très important dans notre organisme, ils en assurent le bon fonctionnement. Chacun de ces électrolytes a une fonction distincte et se retrouve à différents endroits, tels que le plasma sanguin ou le liquide interstitiel qui englobe les cellules et qui constitue le liquide extracellulaire.
Principaux électrolytes
Les électrolytes les plus notoires sont :
- la saumure (solution aqueuse de sel alimentaire, NaCl), historiquement le premier électrolyte utilisé (dans la pile de Volta en 1800) ;
- les solutions d'acide sulfurique, utilisées dans les batteries au plomb ;
- les solutions de potasse 5 à 8 M, utilisées dans les batteries alcalines de types Ni-Cd ou Ni-MH ;
- les solutions de LiPF6 dans des mélanges de solvants organiques de type « carbonate », utilisées dans les batteries lithium-ion ;
- les solutions de sulfate de cuivre, de zinc ou de nickel en milieu acide sulfurique, utilisées pour les revêtements électrolytiques à anode soluble ;
- les sels fondus à base d'alumine et de cryolite, utilisées pour l'électrosynthèse de l'aluminium (voir l'article détaillé Production de l'aluminium par électrolyse).
Voir aussi
Références
- Douglas Skoog, Donald West, F. James Holler, Chimie analytique, De Boeck Supérieur, 1997
