Électrophorèse des protéines

L'électrophorèse des protéines (ou des protides) est une méthode d'analyse d'un mélange de protéines par une électrophorèse sur gel. Elle repose sur la capacité des protéines chargées à migrer au travers des pores d'un gel lorsqu'on applique un courant électrique. Elle est employée en protéomique ainsi qu'en médecine, principalement à partir de sérum sanguin (le plasma sanguin ne convient pas).
L'électrophorèse est une technique chimique d'analyse des masses des molécules. Si on maîtrise la porosité fine du gel, les molécules vont migrer vers le pôle électrique opposé de leur charge en fonction de leur taille.
Principe
[modifier | modifier le code]
Les protéines rouges sont des molécules amphotères (qui portent des charges positives et négatives localisées sur les chaînes latérales des acides aminés). Elles adoptent des structures tridimensionnelles caractéristiques et certaines charges peuvent être exposées à la surface de la molécule, comme elles peuvent être enfouies au cœur de la molécule. L'analyse comparative des masses moléculaires va donc s'effectuer sur des protéines dénaturées de leurs structures tertiaires et secondaires. Un détergent de type anionique recouvre les chaînes de polymère dénaturé en leur conférant une charge (rapport charge/acide-aminé constant). Les différentes protéines d'un mélange complexe se trouvent donc recouvertes d'un « manteau » de charges négatives.
Lorsqu'on applique une tension continue entre les extrémités d'un gel où a été déposé le mélange complexe de protéines, les protéines migrent au travers des mailles constituant le gel. Les mailles du gel retiendront moins les petites molécules qui auront alors la migration la plus grande. Les molécules les plus longues seront d'autant plus retenues entre les mailles du gel et auront une migration relative plus faible.
Différents procédés sont utilisés pour révéler la migration des protéines. La plus courante consiste en une coloration spécifique des protéines. Le gel est coloré et il fait apparaître un profil électrophorétique qui met en évidence des bandes dont l'intensité correspond partiellement à l'abondance dans le mélange et dont la position reflète la masse moléculaire relative. Cette masse moléculaire est comparée à des étalons commerciaux calibrés en unité de masse protéique (Dalton).
Protéinogramme
[modifier | modifier le code]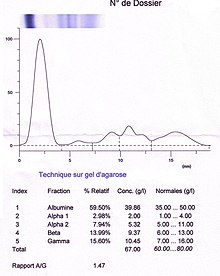
Un protéinogramme est une électrophorèse des protéines sériques. Il s'agit d'un examen médical fréquent et peu coûteux. Il se présente sous la forme d'un tracé comprenant cinq fractions : albumine, α1-globulines, α2-globulines, β-globulines et γ-globulines.
Le plasma ne convient pas pour cet examen car il contient notamment du fibrinogène qui fausse les résultats. De même, un sérum hémolysé est une source d'erreur d'interprétation car la présence d'hémoglobine modifie le tracé.
Albumine
[modifier | modifier le code]C'est la fraction la plus importante (environ 60 %). Elle est homogène et pure (ne contient que l'albumine). Un dédoublement du pic sur l'électrophorèse signe une bisalbuminémie. Une diminution de cette fraction traduisant une hypoalbuminémie s'observe lors d'une cirrhose hépatique ou de syndrome néphrotique.
α1-globulines
[modifier | modifier le code]Protéines clés: α1-antitrypsine et l'orosomucoïde (également appelé α1- glycoprotéine acide)
Cette fraction représentant environ 3 %. Une cirrhose hépatique ou un syndrome néphrotique sont suspectés lors d'une diminution, tandis qu'une augmentation évoque un syndrome inflammatoire.
α2-globulines
[modifier | modifier le code]Protéines clés: L'haptoglobine, l'α2-macroglobuline et la céruléoplasmine
Cette zone représente environ 10 % d'un protéinogramme. Elle est diminuée lors d'une cirrhose hépatique et augmentée lors d'un syndrome inflammatoire ou néphrotique (Les protéines de cette zone sont surproduite pour pallier la perte de pression oncotique engendrée par la fuite de l'albumine. On conclut donc à un syndrome néphrotique que si l'aire en regard du poids de l'albumine est diminuée).
β-globulines
[modifier | modifier le code]Protéines clés: fibrinogène (peu d'influence sur le profil), transferrine, la fraction C3 du complément et les IgA
La fraction des β-globulines représente environ 11 %. Son augmentation est observée lors d'un syndrome néphrotique. La formation d'un « pont » entre les fractions β et γ est typique d'une cirrhose hépatique.
γ-globulines
[modifier | modifier le code]Protéines clés: les immunoglobulines G, M, D et E
Représentant environ 17 %. Une diminution de la zone marque une hypogammaglobulinémie ou un syndrome néphrotique. À l'inverse, une augmentation avec un pic étroit signale une gammapathie monoclonale. Une augmentation en dôme révèle quant à elle une hypergammaglobulinémie polyclonale.
