Oxyde d'iode
Un oxyde d'iode est un composé chimique de l'oxygène et de l'iode. On n'en connaît que deux qui soient stables et séparables en quantités conséquentes : le tétroxyde I2O4 et le pentoxyde I2O5. D'autres ont été observés à l'état de traces ou ne sont que présumés exister.
La chimie de ces composés est compliquée, et seuls quelques-uns ont été bien caractérisés. Plusieurs ont été détectés dans l'atmosphère et sont considérés comme particulièrement importants pour la couche limite marine[1].
Principales caractéristiques
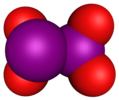
| Formule brute | I2O | IO[3] | I2O3 | IO2 | I2O4 | I4O9 | I2O5 | I2O7 |
|---|---|---|---|---|---|---|---|---|
| Nom | Monoxyde de diiode | Monoxyde d'iode | Dioxyde d'iode | Tétroxyde de diiode | Nonoxide de tétraiode | Pentoxyde de diiode | Heptoxyde de diiode | |
| Formule semi-développée | I2O | IO | IOIO2 | IO2 | (IO2)2 | I(OIO2)3 | O(IO2)2 | |
| Représentation 3D | 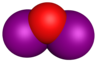
|

|

|
|

|
|||
| Numéro CAS | 39319-71-6 | 14696-98-1 | 13494-92-3 | 1024652-24-1 | 66523-94-2 | 12029-98-0 | ||
| État standard | ? | gaz violet | ? | solide jaune | solide jaune | solide ocre | solide blanc | ? |
| Nombre d'oxydation | +I | +II | +III | +IV | +III et +V | +III et +V | +V | +VII |
| Point de fusion | (non séparable) | (non séparable) | ? | (non séparable) | (décomposé à 100 °C) | (décomposé à 75 °C) | (décomposé à 100–350 °C) | ? |
| Masse volumique (g/cm3) | ? | ? | ? | 4,2 | 4,8 | ? | ? | ? |
| Solubilité dans l'eau | ? | ? | ? | ? | (décomposition en HIO3 + I2) | (décomposition en HIO3 + I2) | 187 g/100 ml | ? |
| Oxoacide dérivé | HIO Acide hypoiodeux |
HIO2 Acide iodeux |
HIO3 Acide iodique |
HIO4 et H5IO6 Acides méta- et orthoperiodique | ||||
| Sels | Hypoiodites | Iodites | Iodates | Periodates |
Le monoxyde de diiode I2O a surtout fait l'objet d'études théoriques[4], mais il semble qu'on puisse le préparer d'une manière similaire au monoxyde de dichlore Cl2O, par réaction de HgO et I2[5]. I2O semble être très instable mais est capable de réagir avec les alcènes pour donner des produits iodés[6].
Le monoxyde d'iode IO (un radical), le dioxyde d'iode IO2 et le tétroxyde de diiode I2O4 interviennent dans la chimie atmosphérique. Ils se forment au niveau de la couche limite marine par photo-oxydation du diiodométhane, qui est lui-même produit par des macroalgues telles que le goémon ou par oxydation de l'iode moléculaire (produit par réaction de l'ozone gazeux et des iodures présents à la surface de la mer)[7],[8]. Bien que présents en proportions infimes, en général moins d'un ppt (10−12), on pense que ce sont de puissants agents de la destruction de la couche d'ozone[9],[10].
Le nonoxyde de tétraiode I4O9 a été préparé par réaction de I2 et O3 en phase gazeuse, mais n'a pas été étudié de manière approfondie[11].
Le pentoxyde de diiode I2O5, anhydride de l'acide iodique, est le seul anhydride stable d'un oxoacide d'iode.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Iodine oxide » (voir la liste des auteurs).
- (en) Nikolas Kaltsoyannis et John M. C. Plane, « Quantum chemical calculations on a selection of iodine-containing species (IO, OIO, INO3, (IO)2, I2O3, I2O4 and I2O5) of importance in the atmosphere », Physical Chemistry Chemical Physics, vol. 10, no 13, , p. 1723-1733 (DOI 10.1039/B715687C, Bibcode 2008PCCP...10.1723K).
- (en) D. R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton (FL), CRC Press, , 86e éd. (ISBN 0-8493-0486-5).
- (en) I. V. Nikitin, « Halogen monoxides », Russian Chemical Reviews, vol. 77, no 8, , p. 739–749 (DOI 10.1070/RC2008v077n08ABEH003788, Bibcode 2008RuCRv..77..739N).
- (en) Igor Novak, « Theoretical study of I2O », Heteroatom Chemistry, vol. 9, no 4, , p. 383–385 (DOI 10.1002/(SICI)1098-1071(1998)9:4<383::AID-HC6>3.0.CO;2-9).
- (en) Craig P. Forbes, André Goosen et Hugh A. H. Laue, « Hypoiodite reaction: kinetic study of the reaction of 1,1-diphenyl-ethylene with mercury(II) oxide iodine », Journal of the Chemical Society, Perkin Transactions 1, , p. 2350–2353 (DOI 10.1039/P19740002350).
- (en) Richard C. Cambie, Rodney C. Hayward, Barry G. Lindsay, Alice I. T. Phan, Peter S. Rutledge et Paul D. Woodgate, « Reactions of iodine oxide with alkenes », Journal of the Chemical Society, Perkin Transactions 1, no 18, , p. 1961 (DOI 10.1039/P19760001961).
- (en) Thorsten Hoffmann, Colin D. O'Dowd et John H. Seinfeld, « Iodine oxide homogeneous nucleation: An explanation for coastal new particle production », Geophysical Research Letters, vol. 28, no 10, , p. 1949–1952 (DOI 10.1029/2000GL012399, Bibcode 2001GeoRL..28.1949H, lire en ligne).
- (en) Lucy J. Carpenter, Samantha M. MacDonald, Marvin D. Shaw, Ravi Kumar, Russell W. Saunders, Rajendran Parthipan et Julie Wilson, « Atmospheric iodine levels influenced by seasurface emissions of inorganic iodine », Nature Geoscience, vol. 6, no 2, , p. 108–111 (DOI 10.1038/ngeo1687, Bibcode 2013NatGe...6..108C, lire en ligne).
- (en) A. Saiz-Lopez, R. P. Fernandez, C. Ordóñez, D. E. Kinnison, J. C. Gómez Martín, J.-F. Lamarque et S. Tilmes, « Iodine chemistry in the troposphere and its effect on ozone », Atmospheric Chemistry and Physics, vol. 14, no 23, , p. 13119–13143 (DOI 10.5194/acp-14-13119-2014, Bibcode 2014ACP....1413119S).
- (en) R. A. Cox, W. J. Bloss, R. L. Jones et D. M. Rowley, « OIO and the atmospheric cycle of iodine », Geophysical Research Letters, vol. 26, no 13, , p. 1857–1860 (DOI 10.1029/1999GL900439, Bibcode 1999GeoRL..26.1857C, lire en ligne).
- (en) S. Sunder, J. C. Wren et A. C. Vikis, « Raman spectra of I4O9 formed by the reaction of iodine with ozone », Journal of Raman Spectroscopy, vol. 16, no 6, , p. 424–426 (DOI 10.1002/jrs.1250160611, Bibcode 1985JRSp...16..424S).
