Transfert thermique

Un transfert thermique, appelé plus communément chaleur[1], est l'un des modes d'échange d'énergie interne entre deux systèmes, l'autre étant le travail : c'est un transfert d'énergie thermique qui s'effectue hors de l'équilibre thermodynamique. On distingue trois types de transfert thermique, qui peuvent coexister :
- la conduction, due à la diffusion progressive de l'agitation thermique dans la matière ;
- la convection, transfert thermique qui accompagne les déplacements macroscopiques de la matière ;
- le rayonnement, qui correspond à la propagation de photons.
La quantité de chaleur Q est la quantité d'énergie échangée[2] par ces trois types de transferts, elle s'exprime en joules (J). Par convention, Q > 0 si le système reçoit de l'énergie. La thermodynamique s’appuie sur le concept de chaleur pour ériger le premier et le deuxième principe de la thermodynamique.
La signification du mot « chaleur » dans le langage courant entretient souvent des ambiguïtés et des confusions, notamment avec la température. S'il est vrai que les transferts thermiques spontanés se font depuis les régions de température plus élevée vers les régions de température plus basse, il est néanmoins possible de réaliser un transfert thermique d'un corps froid vers le corps chaud, à l'aide d'une machine thermique comme un réfrigérateur. Par ailleurs, lors d'un changement d'état, par exemple lors de l'ébullition, un corps pur ne change pas de température alors qu'il échange de l'énergie sous forme de chaleur.
L'exemple le plus simple de situation mettant en jeu un transfert thermique est celui de deux corps en contact ayant des températures différentes. Le corps le plus chaud cède de l'énergie au corps le plus froid par conduction ; sa température diminue, le désordre, l'agitation thermique, diminue. En contrepartie, la température du corps froid augmente, l'agitation thermique augmente en son sein.
Historique et évolution de la terminologie
[modifier | modifier le code]La chaleur, dans le langage courant, est souvent confondue avec la notion de température. Bien que très différentes d'un point de vue scientifique, les deux notions sont tout de même reliées et la genèse de la thermodynamique a parfois induit cette confusion. Les expressions comme « l'eau est chaude » pourrait faire croire, à tort, que la chaleur est une propriété du système alors qu'il s'agit d'un transfert d'énergie (de l'eau, chaude, vers l'environnement environnant, plus froid). Aussi, il est incorrect de dire « l'eau perd de la chaleur » lorsqu'elle refroidit. L'expression « transfert de chaleur » est un pléonasme pourtant très répandu[2].
Jusqu'au XVIIIe siècle, les scientifiques pensaient que la chaleur était constituée d'un fluide que l'on avait nommé le phlogistique (théorie du phlogistique).
Au XIXe siècle, la chaleur est assimilée à un fluide : le calorique. Les progrès et les succès de la calorimétrie imposent cette théorie jusqu'au milieu du XIXe siècle. Cette conception est par exemple reprise par Sadi Carnot : un moteur thermique ne peut fonctionner que si la chaleur circule d'un corps dont la température est plus élevée vers un corps dont la température est plus faible ; raisonnement correspondant à une analogie avec une machine hydraulique qui tire son énergie du passage de l'eau d'un réservoir d'altitude élevée vers un réservoir d'altitude inférieure.
Ce n'est qu'avec l'avènement de la thermodynamique statistique que la chaleur sera définie comme un transfert de l'agitation thermique des particules au niveau microscopique. Un système dont les particules sont statistiquement plus agitées présentera une température d'équilibre, définie à l'échelle macroscopique, plus élevée. La température est donc une grandeur macroscopique qui est le reflet statistique des énergies cinétiques des particules à l'échelle microscopique. Au cours de chocs aléatoires, les particules les plus agitées transmettent leurs énergies cinétiques aux particules les moins agitées. Le bilan de ces transferts d'énergies cinétiques microscopiques correspond à la chaleur échangée entre des systèmes constitués de particules dont l'agitation thermique moyenne est différente.
La température est une fonction d'état intensive servant à décrire l'état d'équilibre d'un système alors que la chaleur est un transfert d'agitation thermique assimilable à une quantité d'énergie, associé à l'évolution d'un système entre deux états distincts ou identiques si la transformation est cyclique.
Modes de transferts thermiques
[modifier | modifier le code]Les modes fondamentaux de transfert thermique sont :
- la conduction ou diffusion : le transfert d'énergie entre objets en contact physique ;
- la convection : le transfert d'énergie entre un objet et son environnement, dû à un mouvement fluide ;
- le rayonnement : le transfert d'énergie par l'émission de rayonnement électromagnétique.
Pour les quantifier, il est pratique d'utiliser le flux thermique , qui est la puissance échangée, en watts (W), ou encore mieux, la densité de flux thermique (ou flux thermique surfacique) en watts par mètre carré (W m−2).
Conduction
[modifier | modifier le code]
Le transfert par conduction est un échange d'énergie se réalisant sans déplacement de matière : il concerne donc les solides et les fluides immobilisés. Ce transfert peut se réaliser au sein d'un seul corps ou par contact entre deux corps. L'énergie thermique, ou vibration des atomes autour de leur position d'équilibre dans le solide, se transmet de proche en proche par un phénomène de diffusion. Les cristaux disposent d'un mode de transfert thermique supplémentaire particulier associé aux vibrations du réseau (voir phonon).
Dans le cas le plus simple d'une paroi d'épaisseur e solide dont les deux surfaces d'aire S présentent une différence de température homogène T1 – T2, le flux thermique dépend de la conductivité thermique λ du matériau (W m−1 K−1) :
- ,
Rth est la résistance thermique de conduction.
Pour une étude plus approfondie, il faut exploiter la loi de Fourier :
- .
C'est une loi de diffusion similaire à la loi de Fick qui décrit la diffusion de la matière.
Convection
[modifier | modifier le code]
Le transfert thermique par convection est dû au déplacement de molécules qui induit un déplacement macroscopique de l'énergie thermique : il se produit dans les fluides (liquides ou gaz) et à l'interface entre un solide et un fluide. Ces molécules se déplaçant, elles transfèrent leur énergie thermique à une autre partie du système. On peut distinguer deux types de convection.
- La convection naturelle (ou libre) est due à la différence de masse volumique entre les particules composant le fluide. Les particules des zones chaudes, de masse volumique plus faible, montent et laissent leur place à des particules plus froides ; elles cèdent une partie de l'énergie thermique et leur température diminue, ce qui les pousse à rejoindre une partie plus chaude.
- La convection forcée est due à la mise en mouvement du fluide par une action extérieure comme un l'effet d'un ventilateur. Le mouvement accélère le transfert thermique.
Dans le cas le plus simple d'une paroi solide de surface S et de température homogène T1 en contact avec un fluide à la température T2 à grande distance de la paroi, le flux thermique dépend du coefficient de convection thermique h du matériau (W m−2 K−1) :
- ,
Rth est la résistance thermique de convection. Autrement écrit, .
Le transfert thermique peut être formulé par la loi de refroidissement de Newton qui indique qu'il est proportionnel à la différence de température entre le corps étudié et son milieu environnant.
Rayonnement
[modifier | modifier le code]
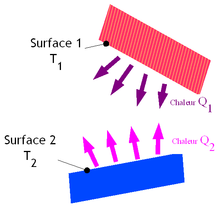
Le rayonnement, parfois dit thermique, est un rayonnement électromagnétique. On l'associe souvent à un rayonnement infrarouge car c'est cette partie du spectre qui est le plus souvent prépondérante dans les échanges thermiques. Quelle que soit sa température, un corps émet un rayonnement, celui-ci est plus ou moins intense selon cette température. La longueur d'onde à laquelle est émise ce rayonnement dépend aussi de cette température. Ainsi, le rayonnement thermique émis par le Soleil est situé principalement dans le visible. Des corps plus froids comme les mammifères émettent quant à eux dans l'infrarouge. Ce mode de transfert est le seul à se réaliser dans le vide, cas du rayonnement solaire arrivant sur Terre. Néanmoins, celui-ci se réalise aussi dans les matériaux transparents. Il est important de le prendre en compte dans le cas des fortes températures ou simplement en l'absence de conduction et de convection.
Le corps noir est un corps théorique capable d'absorber la totalité du rayonnement qu'il reçoit. Il présente la propriété de respecter la loi de Planck et la loi du déplacement de Wien qui permettent de déterminer son spectre d'émission en fonction de sa température.
Le flux thermique surfacique, qui équivaut à une exitance énergétique, s'exprime par rapport à l'émission du corps noir dans la loi de Stefan-Boltzmann :
- ,
avec
- : constante de Stefan-Boltzmann (5,670 3 × 10−8 W m−2 K−4) ;
- : émissivité, indice valant 1 pour un corps noir et qui est compris entre 0 et 1 selon l’état de surface du matériau (sans dimension) ;
- : température du corps (K).
Si le corps récepteur réfléchit certaines longueurs d'onde ou est transparent à d'autres, seules les longueurs d'onde absorbées contribuent à son équilibre thermique. Si par contre le corps récepteur est un corps noir, c'est-à-dire qu'il absorbe tous les rayonnements électromagnétiques, alors tous les rayonnements contribuent à son équilibre thermique.
Comparaison des modes de transfert
[modifier | modifier le code]| Mode de transfert | Matière de transfert | Milieu de transfert | Transport de matière |
|---|---|---|---|
| Conduction | Solides et fluides | Au sein d'un seul corps ou par contact entre deux corps | Non |
| Convection | Fluides[a] | Au sein d'un seul fluide ou au contact entre un solide et un fluide | Oui |
| Rayonnement | Solides, fluides et vide | À partir d'un corps rayonnant vers un autre | Non |
Combinaison des modes de transfert
[modifier | modifier le code]Le transfert d'énergie par chaleur se réalise généralement par une combinaison de plusieurs modes de transfert. Par exemple, un chauffage central, combine successivement la convection (en général forcée) pour chauffer le circuit du fluide caloporteur à partir de la chaudière, puis la conduction pour chauffer les parois du radiateur qui à leur tour réchauffent l'air en contact, et enfin la convection (en général naturelle) de l'air associée au rayonnement de la masse du radiateur (d'où le nom de ce dernier).
Parfois le transfert thermique s'accompagne d'un transfert de matière. Par exemple, dans le cas de l'ébullition d'un liquide, une partie du liquide subit un changement d'état physique et le gaz ainsi créé se sépare du liquide.
Chaleur et thermodynamique
[modifier | modifier le code]Évolution spontanée de deux corps en contact
[modifier | modifier le code]Soient deux objets A et B indéformables (δW = 0) formant un système isolé (δQ = 0). Conformément au premier principe de la thermodynamique, la variation de l'énergie interne est égale à la somme de la chaleur et du travail : δW + δQ = dU.
Si δQA et δQB sont respectivement les énergies thermiques élémentaires échangées entre l’objet A et l’objet B, δQA + δQB = δQ = 0, d’où : δQA = – δQB.
Le deuxième principe de la thermodynamique permet d’écrire la relation suivante liant les entropies des objets A et B :
- ,
puisque le système est isolé. Par définition, , alors, il vient :
- .
Si δQA < 0 et donc que δQB > 0, alors TA > TB. En vertu de la règle des signes, on conclut que l’objet A cède de la chaleur à l’objet B. L’objet le plus chaud cède donc de la chaleur à l’objet le plus froid.
Premier principe et chaleur
[modifier | modifier le code]Le premier principe de la thermodynamique est un principe de conservation de l'énergie. Il introduit la fonction d'état énergie interne U.
Au cours d'une transformation d'un système thermodynamique fermé, entre deux états I initial et F final, la variation de l'énergie interne est due à la somme :
- des travaux réalisés , c'est-à-dire des transferts d'énergie microscopique ordonnée ; en général le travail des forces de pression ;
- des chaleurs , c'est du transfert d'énergie microscopique désordonnée.
Ce qui se traduit par : .
On en déduit donc une définition formelle de la chaleur le long d'un chemin bien défini allant de I à F :
L'intégrale curviligne permettant le calcul du travail des forces de pression: , n'est pas indépendante du chemin suivi pour aller de I vers F car le travail n'est pas une fonction d'état. Il s'ensuit également que la chaleur n'est pas une fonction d'état et donc qu'elle dépend du chemin suivi. Notamment si la transformation permettant d'amener un corps de l'état I à l'état F est réalisée de deux façons différentes, les chaleurs mises en jeu sont également a priori différentes.
Néanmoins dans certaines conditions expérimentales, la chaleur mise en jeu est égale à la variation d'une fonction d'état. En voici quelques exemples, pour un système fermé contenant n moles de matière.
Transformations particulières
[modifier | modifier le code]- Transformation adiabatique : , il n'y a pas de chaleur échangée avec l'extérieur.
- Transformation isochore (à volume constant) : , où la capacité thermique molaire à volume constant est notée .
- Transformation isobare (à pression constante) : , où la capacité thermique molaire à pression constante est notée .
- Changement d'état d'un corps pur (pression et température constante) : , où l'enthalpie molaire de changement d'état est notée , anciennement nommée chaleur latente[3] molaire de changement d'état.
Ces propriétés sont mises à profit dans le domaine de la calorimétrie effectuée dans un calorimètre fonctionnant soit à pression constante soit à volume constant dans le cas d'une bombe calorimétrique.
Deuxième principe et chaleur
[modifier | modifier le code]Le deuxième principe de la thermodynamique est un principe d'évolution. Il introduit la fonction d'état entropie qui est une mesure du désordre de la matière. La fonction entropie est définie à l'échelle macroscopique de telle sorte que sa variation au cours de la transformation réversible d'un système correspond au rapport de la quantité de chaleur échangée avec le milieu extérieur sur la température du système :
- .
Et pour une transformation finie à température T constante, allant d'un état I à un état F d'équilibre :
- .
La chaleur est donc associée à une variation d'entropie. Or, plus il y a création d'entropie, plus la transformation est irréversible et plus le travail utile récupéré sera faible : la chaleur est « une dégradation qualitative de l'énergie »[réf. souhaitée].
Notes et références
[modifier | modifier le code]Notes
[modifier | modifier le code]- Il suffit, plus exactement, que le milieu puisse se déformer indéfiniment quand il est soumis à une contrainte maintenue durablement. C'est le cas des fluides au sens propre (liquides et gaz) mais aussi des solides rhéologiques à très long terme. Le manteau terrestre, notamment, se comporte comme un solide élastique à court terme (d'une fraction de seconde à plusieurs années), mais comme un fluide à l'échelle de millions ou milliards d'années : il est soumis à des courants de convection (convection mantellique).
Références
[modifier | modifier le code]- Stéphane Olivier et Hubert Gié, Thermodynamique, Paris, Tec & Doc Lavoisier, coll. « Sciences physiques », , 512 p. (ISBN 978-2-7430-0133-9), p. 133
, assorti d'un appel de note de bas de page qui explique :« Un tel transfert d'énergie est appelé chaleur ou, mieux, transfert thermique et noté Q. »
« Le mot « chaleur » est de loin le plus utilisé : c'est un héritage légué par les fondateurs de la thermodynamique, et qui s'impose par sa simplicité. L'usage courant de formules telles que « l'eau est chaude » confère au mot « chaleur » une ambiguïté regrettable : on sous-entend ainsi que la chaleur est une forme d'énergie stockée par l'eau, alors que la chaleur n'est qu'une forme d'échange d'énergie. »
- Richard Taillet, Loïc Villain et Pascal Febvre 2018
- La chaleur latente est la quantité de chaleur échangée par un système lors d'un transformation isotherme ; par opposition, la chaleur sensible est la quantité de chaleur dont l'apport fait varier la température du système. (Richard Taillet, Loïc Villain et Pascal Febvre 2018)
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Bruno Chéron, Transferts Thermiques : Résumé de cours, problèmes corrigés, Ellipses, (ISBN 978-2729899103)
- Esteban Saatdjian, Les bases de la mécanique des fluides et des transferts de chaleur et de masse pour l'ingénieur, Sapientia, (ISBN 978-2911761850)
- René Leleu, Transferts de chaleur, Paris, Éditions techniques de l'ingénieur, (BNF 14017046, lire en ligne [PDF])
- Richard Taillet, Loïc Villain et Pascal Febvre, Dictionnaire de physique, De Boeck Superieur, , 976 p. (ISBN 978-2-8073-0744-5, lire en ligne).

Articles connexes
[modifier | modifier le code]- Énergie thermique
- Chaleur (thermodynamique)
- Température
- Entropie (thermodynamique)
- Enthalpie de changement d'état
- Chaleur sensible
- Corps noir
- Isolation thermique
- Thermique du bâtiment
Liens externes
[modifier | modifier le code]
- Notice dans un dictionnaire ou une encyclopédie généraliste :


















































