Ixodes ricinus
| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Sous-embr. | Chelicerata |
| Classe | Arachnida |
| Sous-classe | Acari |
| Super-ordre | Parasitiformes |
| Ordre | Ixodida |
| Famille | Ixodidae |
| Genre | Ixodes |
- Acarus ricinus Linnaeus, 1758
Ixodes ricinus est une espèce de tiques, un acarien, ectoparasite, venimeux[1] de la famille des Ixodidae.
Appelée tique du mouton et autrefois aussi tique du chien (nom source de confusion car également donné à deux autres espèces de tique : Dermacentor variabilis et Rhipicephalus sanguineus), c'est la tique la plus fréquente en France.
Les populations de cette tique à corps dur[2] semblent en augmentation depuis quelques décennies dans de nombreuses régions de l'hémisphère nord, et elles jouent un rôle écoépidémiologique qui semble important voire majeur dans la transmission de certaines maladies. Des progrès importants dans la connaissance de ce rôle ont été récemment permis par les techniques d'analyse de l'ADN[3] du contenu stomacal des tiques qui renseignent sur les espèces-hôtes (source d'alimentation pour la tique) et sur les éventuelles co-infections par différentes espèces de pathogènes (notamment transmissibles à l'humain : par des rickettsies[4], par des borrélies[5]).
Distribution
[modifier | modifier le code]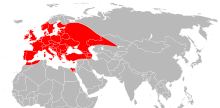
Cette espèce se rencontre en zone paléarctique occidentale. Elle serait en expansion depuis une trentaine d'années[6],[7].
Habitat
[modifier | modifier le code]Cette espèce vit à proximité du sol (litière et herbacées, parfois sur les basses branches d'arbres ou buissons) dans les forêts, bois, haies et zones boisées ou là où elle a pu être transportée par des animaux tels que cervidés ou sangliers.
Elle est largement distribuée en Europe, de l'Afrique du Nord à la Scandinavie et de l'Irlande à la Russie centrale[8],[9] (avec d'importantes variations spatiotemporelles par exemple en Irlande[10], au Royaume-Uni[11], et en Suisse[12]).
En Suisse, sa répartition a été documentée jusqu'à une altitude de 1 450 mètres[13].
Description
[modifier | modifier le code]





Cette espèce est dépourvue d'yeux, mais elle semble pourtant pouvoir se diriger et même cibler des proies ou certaines zones du corps où la peau est plus fine quand elle est entrée en contact avec une proie.
Ces acariens sont pourvus de cellules jouant un rôle similaire à celui de l'odorat (sur une patte) et de cellules photosensibles sur les deux flancs de l'animal[14]. L'animal sait ainsi s'il fait jour ou nuit, et peut détecter des mouvements d'animaux s'ils interceptent la lumière qui arrive à la tique.
Prédateurs
[modifier | modifier le code]Ces tiques (et leurs larves) peuvent être consommées par des oiseaux, des reptiles et des petits mammifères, mais elles semblent aussi dans la nature surtout contrôlées par des parasites et divers microorganismes pathogènes, dont :
- des champignons (dont Metarhizium anisopliae, Beauveria bassiana, Paecilomyces fumosoroseus, qui s'avèrent en laboratoire très efficacement mortels pour les tiques en 5 à 25 jours…) Des blastospores pourraient être plus efficaces que des conidiospores pour le contrôle biologique des tiques.[réf. nécessaire]
- des nématodes (ex. : Steinernema spp. et Heterorhabditis sp. qui sont capables d'inoculer leurs bactéries symbiotes (Xenorhabdus, Photorhabdus) qui tuent rapidement la tique ainsi coparasitée. Ces bactéries liquéfient l'intérieur de la tique que les nématodes peuvent ensuite digérer. Les nématodes ne se reproduisent pas dans la tique, mais ensuite dans l'eau interstitielle du sol ou dans le sol humide). In vitro, 10 à 40 % des tiques femelles non alimentées et contaminées meurent ; S. carpocapsae semblant être le nématode le plus souvent mortel pour ces tiques, d'autant plus que le taux d'infestation est élevée (deux fois plus de mortalité avec un « ensemencement » de 600 nematodes/cm2 de substrat que pour 300 nematodes/cm2.
- des guêpes parasitoïdes qu'on voudrait aussi utiliser pour la lutte biologique contre les tiques mais qu'on ne sait pas encore élever en masse (ex. : Ixodiphagus hookeri (Encyrtidae) et Ixodiphagus caucurtei[15]).
La régression de ces prédateurs pourrait contribuer à une augmentation des populations de tiques.
Rôle dans la santé publique
[modifier | modifier le code]Sa nymphe et surtout l'adulte s'attaquent volontiers à l'humain. I. ricinus est l'une des quelques espèces de tiques qui peuvent transmettre certaines maladies (parasitoses) à l'humain, comme la maladie de Lyme et l'encéphalite à tique (ou méningoencéphalite verno-estivale)[16], l'encéphalite virale ovine (louping ill) chez le mouton[17], et plus rarement la tularémie (ou fièvre du lapin)[18] ou la fièvre Q (infection par la bactérie Coxiella burnetii)[19].
Allergies
[modifier | modifier le code]Cette espèce (comme d'autres espèces de tiques s'attaquant à l'humain) peut être source d'au moins deux types d'allergies :
- allergie à la salive de tique ;
- allergie à la viande.
Pathogénicité et interactions durables avec les Borrélies
[modifier | modifier le code]Ixodes ricinus, comme toutes les tiques, se développe en passant par plusieurs stades. Elle doit se nourrir de sang. Les individus de chaque stade partent donc en quête d'une proie à parasiter. La quête se fait durant la belle saison, de mai à septembre essentiellement avec des variations selon la latitude et l'altitude. Le suivi de cette espèce en Suisse (depuis 1996) a montré que cette espèce est très sensible au climat et en particulier à la douceur des températures hivernales et aux températures nocturnes de la belle saison. Ainsi, les tiques de l'ouest de la Suisse escaladent les herbacées et entament leur quête de proie dès février si la température moyenne de janvier dépassait 4 °C, mais elles n'apparaissent qu'en mars si cette même température n'a pas dépassé 2 °C. Au-delà d'une certaine altitude, elles ne survivent pas[20].
Au début des années 2000, Jean-Luc Perret a montré que les déplacements des nymphes sont essentiellement nocturnes et qu'ils sont fortement influencés par les conditions thermohygrométriques, avec deux précisions écoépidémiologiquement importantes :
- en laboratoire, ces déplacements doublent (en moyenne) quand la température passe de 15 à 25 °C (la tique effectue un trajet moyen de 44 cm/nuit par une humidité correspondant à une température de 15 °C, à 110 cm dans un air plus sec à 25 °C. En condition de laboratoire, certaines tiques ont ainsi parcouru jusqu'à 9,6 mètres en une nuit ;
- de plus, Jean-Luc Perret a noté que quand l'atmosphère est plus sèche et plus chaude, les déplacements de cet arthropode sont très exacerbés s'il est infecté par certains spirochètes ; Ainsi, les tiques infectées par Borrelia Burgdorferi (sensu lato), qui est l'agent bactérie responsable d'une grande partie des maladies de Lyme en Amérique du Nord se déplaçaient plus souvent et sur de plus grandes distances que les tiques non infectées, ce qui est a priori favorable aux chances que la bactérie a d'infecter un nouvel hôte-réservoir puis d'autres tiques. Il est ainsi possible qu'il existe une interaction durable résultant de la coévolution des spirochètes et des tiques et peut-être d'espèces-hôtes qui ait rendu le parasite capable de contrôler une partie du comportement de l'arthropode. C'est un phénomène connu chez d'autres espèces.
Le drainage des forêts, et leur déshydratation par les routes qui les traversent et par les coupes rases, combinés au réchauffement climatique pourraient donc exacerber la circulation des tiques et les "chances" qu'elles ont de contacter de nouvelles espèces réservoir et d'ainsi étendre les zones où la maladie est endémique. L'impact du climat sur les tiques (dont I. ricinus) est encore débattu, mais la population suédoise de l'espèce I. ricinus est en nette extension vers le nord et vers l'ouest, selon un schéma spatiotemporel qui évoque une relation avec le réchauffement climatique[21],[22].
Le microclimat et le climat régional exercent une influence importante sur la durée de la quête. Les nymphes d’Ixodes ricinus restent à l'affût pendant 20 heures dans des conditions sèches, mais elles sont capables de patienter jusqu'à 40 heures sitôt que l'humidité et la température augmentent. Passé ce délai, elles reviennent au sol pour se réhydrater dans la litière humide. Une fois requinquée, parfois dès la nuit suivante, la tique se met spontanément en route pour trouver une place idéale dans la perspective d'une nouvelle quête.
Des tests sont faits sur le terrain (université de Bourgogne – IRD) pour étudier la spécificité des sexes vis-à-vis des hôtes vertébrés d’Ixodes ricinus[23].
Tiques vectrices de pathogènes multiples et co-infections
[modifier | modifier le code]Le portage de plusieurs pathogènes n'est pas rare chez les tiques. En France, dans les Pyrénées, une étude des tiques errantes en 2019 a montré que la prévalence des pathogènes était de 8,4 % pour Borrelia burgdorferi s.l., 0,4 % pour Babesia spp., 6,1 % pour Anaplasma phagocytophilum, 17,6 % pour Rickettsia spp. et 8,1 % pour Rickettsia du groupe de la fièvre pourprée. La présence de Babesia sp. EU1, Rickettsia helvetica et, pour la première fois en France, Rickettsia monacensis a été montrée[24].
Chez 1 000 spécimens d'Ixodes ricinus prélevés dans une zone de loisirs boisée de Thuringe (Allemagne), on a recherché des Borrelia spp., Babesia spp., Anaplasma spp., Rickettsia, Coxiella burnetii, et Francisella tularensis. 43,6 % de ces 100 tiques étaient infectées par au moins un de ces pathogènes. Et, dans 8,4 % des cas, deux pathogènes différents coexistaient dans la tique (et 3 ou plus dans 1,6 % du lot étudié)[25].
Le groupe de travail "Tiques et Maladies à Tiques"[23] du Réseau Écologie des Interactions Durables (REID) s'intéresse en France aussi à l' « écologie intra-tique » des micropathogènes véhiculés par les tiques, et en particulier aux phénomènes de co-infections et de conflits entre pathogènes se développant à l'intérieur d'Ixodes ricinus ou ingérés par cette dernière et y survivant en étant capables d'interagir avec d'autres pathogènes.
I. ricinus et quelques autres espèces (Ixodes hexagonus, Dermacentor reticulatus, Rhipicephalus bursa et Ornithodoros savignyi…) pourraient aussi jouer un rôle important dans la conservation hivernale de virus réputés transmis par d'autres vecteurs (moustiques et culicoides) ; on a ainsi démontré[26] (étude par PCR en temps réel) chez Ixodes ricinus et d'autres espèces que ces tiques contaminées par des orbivirus lors d'un repas de sang voyaient le virus traverser leur barrière intestinale et diffuser dans l'hémolymphe vers les glandes salivaires et les ovaires. 3 semaines après nourrissage, le virus BTV8 était par exemple trouvé dans beaucoup de tissus et organes des tiques dures (contre 26 jours pour les Ornithodoros)[26].
Et le virus persistait bien dans la tique après chaque mue (« passage transstadial »).
Un passage transovarien (⇒ passage du virus à la descendance) est même observé en laboratoire chez les tiques molles (alors qu'il n'a jamais pu être observé chez les culicoides vecteurs du virus Blue tongue[27]) laissant penser que certaines tiques ont un réel potentiel vectoriel[26]. Ceci expliquerait aussi l'énigme de la survie hivernale de certains virus en Europe[26]. En effet, des années 1970 à 2000 on admettait que le principal vecteur européens du virus BTV8 était être Culicoides dewulfi, et Culicoides chiopterus (Nevill 1971; Wilson et al. 2008), or le virus ne semble pas pouvoir survivre chez ces espèces en hiver en Europe du Nord-Ouest[28].
Les capacités vectorielles d'une tique molle (Ornithodoros coriaceus) avaient d'ailleurs déjà été expérimentalement démontrées pour le BTV (Bluetongue Virus) en 1985[29], avec une contamination via alimentation sur membrane artificielle ou sur des moutons ou bovins infectés. Elles s'étaient montrées capables de transmettre le virus[29].
Maladie de Lyme
[modifier | modifier le code]La maladie de Lyme semble émergente et en rapide augmentation. Elle touche ceux qui vivent et travaillent en forêt, mais aussi un nombre croissant d'urbains piqués par des tiques, en vacances ou lors de promenades dominicales[30]. La fréquence des promenades en forêt, et une prolifération des tiques probablement favorisée par les dérèglements climatiques et par certaines modifications écopaysagères dans de nombreuses régions boisées ou forestières de l'hémisphère nord semblent pouvoir expliquer une augmentation des cas de cette maladie ;
- régression des parasites et entomopathogènes qui devraient normalement décimer une partie des populations naturelles de tiques,
- augmentation de populations-réservoirs (micromammifères…)
- augmentation d'espèces porteuses de borrélies pathogènes (espèces-gibier dont cervidés et sangliers qui peuvent rapidement les véhiculer sur de grandes distances) et qui sont sur-favorisées par l'agrainage et par le recul ou la disparition de leurs prédateurs sauvages qui n'éliminent donc plus les animaux malades ou les plus parasités.
Selon une étude suisse publiée en 2004[31], le taux de tiques infectées et le nombre de tiques varie sensiblement selon les années et selon le gradient altitudinal, mais (à titre d'exemple et pour cette zone et période d'étude) :
- plus l'altitude est basse, plus les tiques sont nombreuses à être infectées, et plus élevée est la diversité de borrélias trouvées ;
- les adultes sont plus nombreux à être infectés que les nymphes (30 % des adultes (qui se sont plus souvent nourries sur des mammifères tels que chevreuil, sanglier ou lapin) étaient infectés contre 21 % des nymphes, qui se nourrissent plutôt sur des oiseaux et micromammifères) ;
- plus il y a de tiques adulte dans l'environnement, plus les tiques sont infectées par B. burgdorferi chez les adultes, mais non chez les nymphes, ce qui laisse penser que le degré de prévalence de l'infection chez les espèces réservoir est écoépidémiologiquement important ;
- cinq espèces de borrelies ont été trouvées : B. garinii, B. burgdorferi (sensu stricto), B. afzelii, B. valaisiana, et B. lusitaniae.
- 5 tiques sur 140 infectées étaient infectées par deux espèces différentes de borrélias.
Au Pays basque espagnol, une étude[32] a recherché des Borrélias chez 7 835 tiques (Ixodes spp., de huit espèces différentes). Un peu moins de 12,5 % des I. ricinus adultes en portaient, contre seulement un peu plus de 0,6 % des nymphes. Deux ans plus tard, 1535 tiques ont été collectées sur 10 zones, là où I. ricinus était l'espèce dominante. Des tiques infectées ont été trouvées dans toutes les zones (9,3 % des adultes et 1,5 % des nymphes). Neuf isolats de B. burgdorferi ont été trouvés, appartenant à quatre espèces différentes (B. burgdorferi sensu stricto, B. garinii, B. valaisiana, et B. lusitaniae), ce qui laisse penser que la maladie de Lyme peut aussi s'exprimer dans ces régions.
Propriétés de la salive
[modifier | modifier le code]La dangerosité de la tique est favorisée par les propriétés anesthésiantes de la salive : il arrive régulièrement que des personnes soient porteuses de tiques se gonflant de sang, sans aucun avertissement sensoriel. Un examen minutieux de la peau s'avère utile après des randonnées dans les herbages, les régions buissonneuses ou les forêts susceptibles d'héberger le parasite. De plus la salive contient des substances capables d'inhiber la coagulation du sang. Cette propriété est mise à profit par des équipes de chercheurs afin de mettre au point un anti-thrombotique injectable et ne provoquant pas de saignement [33].
Publication originale
[modifier | modifier le code]- (la) Linnaeus, 1758 : Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, ed. 10 (texte intégral).
Notes et références
[modifier | modifier le code]- (en) Alejandro Cabezas-Cruz et James J Valdés, « Are ticks venomous animals? », Frontiers in Zoology, vol. 11, no 1, , p. 47 (ISSN 1742-9994, PMID 25006341, PMCID PMC4085379, DOI 10.1186/1742-9994-11-47, lire en ligne, consulté le )
- (en) AJ Mangold, MD Bargues et S Mas-Coma, « 18S rRNA gene sequences and phylogenetic relationships of European hard-tick species (Acari: Ixodidae) », Parasitol Res., vol. 84, no 1, , p. 31–7 (PMID 9491423, DOI 10.1007/s004360050352)
- Humair PF, Douet V, Morán Cadenas F, Schouls LM, Van De Pol I, Gern L (2007) Molecular identification of bloodmeal source in Ixodes ricinus ticks using 12S rDNA as a genetic marker ; J Med Entomol 44:869–880
- Estrada-Pena A, Osacar JJ, Pichon B, Gray JS (2005) Host and pathogen detection for immature stages of Ixodes ricinus (Acari: Ixodidae) in north-central Spain. Exp Appl Acarol 37:257–268
- Fernandez-Soto P, Perez-Sanchez R, Encinas-Grandes A, Sanz RA (2004) Detection and identification of Rickettsia helvetica and Rickettsia sp. IRS3/IRS4 in Ixodes ricinus ticks found on humans in Spain. Eur J Clin Microbiol Infect Dis 23:648–649
- (en) TG Jaenson, « Changes in the geographical distribution and abundance of the tick Ixodes ricinus during the past 30 years in Sweden », Parasit vectors, vol. 5, no 8, (PMID 22233771, DOI 10.1186/1756-3305-5-8)
- (en) JM Medlock, « Driving forces for changes in geographical distribution of Ixodes ricinus ticks in Europe », Parasit vectors, vol. 6, no 1, (PMID 23281838, DOI 10.1186/1756-3305-6-1)
- (en) Gern, L. et P. F. Humair. « Ecology of Borrelia burgdorferi sensu lato in Europe » in J. Gray O. Kahl R. S. Lane G. Stanek Lyme borreliosis biology, epidemiology and control 2002. p. 149-174. CAB International Wallingford, Oxon, United Kingdom
- (en) E. I. Korenberg, « Seasonal population dynamics of Ixodes ticks and tick-borne encephalitis virus », Exp Appl Acarol., no 24, , p. 665–681 (PMID 11227825)
- (en) J. S. Gray, « Studies on the dynamics of active populations of the sheep tick, Ixodes ricinus L. in Co. Wicklow, Ireland », Acarologia, vol. XXV, , p. 167–178
- (en) « Impact of climatic change on the northern latitude limit and population density of the disease-transmitting European tick Ixodes ricinus », Environ Health Perspect., no 108, , p. 119–123 (lire en ligne)
- (en) J. L. Perret, E. Guigoz, O. Rais et L. Gern, « Influence of saturation deficit and temperature on Ixodes ricinus tick questing activity in a Lyme borreliosis-endemic area (Switzerland) », Parasitol Res., no 86, , p. 554–557 (PMID 10935905)
- A Cotty, A. Aeschlimann et S. Schneeberger, « Distribution et fluctuation d’Ixodes ricinus (L.), Haemaphysalis punctata (Can & Franz.) et Dermacentor marginatus (Sulzer) (Acarina, Ixodoidea) en Suisse », Mitt Schweiz Entomol Ges., no 59, , p. 139–150
- (en) Guerin PM, Kröber T, McMahon C, Guerenstein P, Grenacher S, Vlimant M et al. « Chemsensory and behavioural adaptations of ectoparasitic arthropods » Nova Acta Leopoldina 2000;83(316):213-29. Lire en ligne
- (en) Dr Kathrin Hartelt RPS, Landesgesundheitsamt « Biological control of the tick Ixodes ricinus with entomopathogenic fungi, nematodes and parasitic wasps » (Le contrôle biologique des tiques du genre Ixodes ricinus par des champignons, des nématodes et des guêpes parasitoïdes entomopathogènes) Voir (PDF d'un PowerPoint de 18 diapositives)
- (en) Lindgren E, Tälleklint L, Polfeldt T, « Impact of climatic change on the northern latitude limit and population density of the disease-transmitting European tick Ixodes ricinus », Environ Health Perspect., vol. 108, no 2, , p. 119–23 (PMID 10656851, DOI 10.2307/3454509)
- (en) « Louping ill » [PDF], Center for Food Security and Public Health, College of Veterinary Medicine, Iowa State University,
- Office fédéral de la santé publique OFSP, « Tularémie / Fièvre du lapin », sur www.bag.admin.ch (consulté le )
- Office fédéral de la santé publique OFSP, « Fièvre Q », sur www.bag.admin.ch (consulté le )
- article intitulé Quand les tiques jouent à Loft Story, du 10 mars 2003 relatif à la thèse de Jean-Luc Perret
- (en) Tälleklint, L. and T. G T. Jaenson, « Increasing geographical distribution and density of Ixodes ricinus (Acari: Ixodidae) in central and northern Sweden », J Med Entomol., no 35, , p. 521–526 (PMID 9701939)
- (en) Lindgren, E., L. T. älleklint, and T. Polfeldt, « Impact of climatic change on the northern latitude limit and population density of the disease-transmitting European tick Ixodes ricinus », Environ Health Perspect., no 108, , p. 119–123 (PMID 10656851)
- Groupe de Travail "Tiques et Maladies à Tiques"
- Toufic Akl, Gilles Bourgoin, Marie-Line Souq, Joël Appolinaire, Marie-Thérèse Poirel, Philippe Gibert, Georges Abi Rizk, Mathieu Garel et Lionel Zenner, « Detection of tick-borne pathogens in questing Ixodes ricinus in the French Pyrenees and first identification of Rickettsia monacensis in France », Parasite, vol. 26, , p. 20 (ISSN 1776-1042, PMID 30943150, DOI 10.1051/parasite/2019019, lire en ligne
 )
)
- (en) Anke Hildebrandt, Jan Franke, Gernot Schmoock, Katharina Pauliks, Angela Krämer et Eberhard Straube, « Diversity and Coexistence of Tick-Borne Pathogens in Central Germany », Journal of Medical Entomology, vol. 48, no 3, , p. 651-655 (DOI 10.1603/ME10254, résumé)
- Bouwknegt C, van Rijn PA, Schipper JJ, Hölzel D, Boonstra J, Nijhof AM, van Rooij EM, Jongejan F. Potential role of ticks as vectors of bluetongue virus. Exp Appl Acarol. 2010 Apr 1.
- (en) Mellor PS, « The replication of bluetongue virus in Culicoides vectors », Curr Top Microbiol Immunol., no 162, , p. 143–161
- (en) Wilson A, Darpel K, Mellor PS, « Where does bluetongue virus sleep in the winter? », PLoS Biol, vol. 6, no 8, , p. 1612–1617
- (en) Stott JL, Osburn BI, Alexander L, « Ornithodoros coriaceus (pajaroello tick) as a vector of bluetongue virus », Am J Vet Res., no 46, , p. 1197–1199
- Pichot J., Gilot B., Almire N., Polette K. Et Degeilh B., « Ixodes populations (Ixodes ricinus Linné, 1758 ; Ixodes hexagonus Leach, 1815) in the city of Lyon (France) and its outskirts : preliminary results », Parasite, no 2, , p. 167-171
- (en) Fatima Jouda,Jean-Luc Perret, Lise Gern, « Ixodes ricinus Density, and Distribution and Prevalence of Borrelia burgdorferi Sensu Lato Infection Along an Altitudinal Gradient », Journal of Medical Entomology, BioOne, vol. 41, no 2, , p. 162-169 (DOI 10.1603/0022-2585-41.2.162, lire en ligne)
- (en) Marta Barralab, Ana L. García-pérezb, Ramón A. Justeb, Ana Hurtadob, Raquel Escuderoc, Ricela E. Sellekcd, and Pedro Andac, « Distribution of Borrelia burgdorferi sensu lato in Ixodes ricinus (Acari: Ixodidae) Ticks from the Basque Country, Spain », Journal of Medical Entomology (Published by: Entomological Society of America), vol. 39, no 1, , p. 177-184
- (en) Travaux du professeur Edmond Godfroid de l'Unité de Biologie Moléculaire de l'Université libre de Bruxelles (ULB) et collaborateurs
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- (en) Référence Catalogue of Life : Ixodes ricinus Linnaeus, 1758 (consulté le )
- (en) Référence Fauna Europaea : Ixodes (Ixodes) ricinus (Linnaeus, 1758) (consulté le )
- (fr) Référence INPN : Ixodes ricinus (Linnaeus, 1758) (TAXREF)
- (en) Référence NCBI : Ixodes ricinus (taxons inclus)
- Référence « Classification de Hallan »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
Bibliographie
[modifier | modifier le code]- Barandika JF, Hurtado A, Juste RA & García-Pérez AL (2010) Seasonal dynamics of Ixodes ricinus in a 3-year period in northern Spain: first survey on the presence of tick-borne encephalitis virus ; Vector Borne Zoonotic Dis. 2010 Dec ; 10(10):1027-35 ; doi: 10.1089/vbz.2009.0148 (résumé)
- Estrada-Pena A, Osacar JJ, Pichon B, Gray JS (2005) Host and pathogen detection for immature stages of Ixodes ricinus (Acari: Ixodidae) in north-central Spain. Exp Appl Acarol 37:257–268
- Franke J, Meier F, Moldenhauer A, Straube E, Dorn W, Hildebrandt A (2010) Established and emerging pathogens in Ixodes ricinus ticks collected from birds on a conservation island in the Baltic Sea. Med Vet Entomol 24(4):425–432
- Kirstein F, Gray JS (1996) A molecular marker for the identification of the zoonotic reservoirs of Lyme borreliosis by analysis of the blood meal in its European vector, Ixodes ricinus. Appl Environ Microbiol 62:4060–4065
- Kurtenbach K, Kampen H, Dizij A, Arndt S, Seitz HM, Schaible UE, Simon MM (1995) Infestation of rodents with larval Ixodes ricinus (Acari: Ixodidae) is an important factor in the transmission cycle of Borrelia burgdorferi s.l. in German woodlands. J Med Entomol 32(6):807–817
- L’Hostis M, Dumon H, Dorchies B, Boisdron F, Gorenflot A (1995) Seasonal incidence and ecology of the tick Ixodes ricinus (Acari: Ixodidae) on grazing pastures in Western France. Exp Appl Acarol 19:211–220
- Liz JS, Anderes L, Sumner JW, Massung RF, Gern L, Rutti B, Brossard M (2000) PCR detection of granulocytic ehrlichiae in Ixodes ricinus ticks and wild small mammals in Western Switzerland. J Clin Microbiol 38(3):1002–1007
- Michalik J, Skotarczak B, Skoracki M, Wodecka B, Sikora B, Hofman T, Rymaszewska A, Sawczuk M (2005) Borrelia burgdorferi sensu stricto in yellow-necked mice and feeding Ixodes ricinus ticks in a forest habitat of west central Poland. J Med Entomol 5:850–856
- Michalik J, Wodecka B, Skoracki M, Sikora B, Stańczak J (2008) Prevalence of avian-associated Borrelia burgdorferi s.l. genospecies in Ixodes ricinus ticks collected from blackbirds (Turdus merula) and song thrushes (T. philomelos). Int J Med Microbiol 298(S1):129–138
- Nilsson K, Lindquist O, Liu AJ, Jaenson TG, Friman G, Pahlson C (1999) Rickettsia helvetica in Ixodes ricinus ticks in Sweden. J Clin Microbiol 37(2):400–403
- Pichon B, Kahl O, Hammer B, Gray JS (2006) Pathogens and host DNA in Ixodes ricinus nymphal ticks from German forest. Vec Bor Zoon Dis 6:382–387
- Rizzoli A, Rosà R, Mantelli B, Pecchioli E, Hauffe H, Tagliapietra V, Beninati T, Neteler M, Genchi C (2004) Ixodes ricinus, transmitted diseases and reservoirs (en italien). Parassitologia 46(1–2):119–122
- Rizzoli A, Rosà R, Mantelli B, Pecchioli E, Hauffe H, Tagliapietra V, Beninati T, Neteler M, Genchi C (2004) Ixodes ricinus, transmitted diseases and reservoirs(en italien). Parassitologia 46(1–2):119–122
- Rymaszewska A (2003) Detection of human factor granulocytic ehrlichiosis in ticks Ixodes ricinus in Western Pomerania. In: Buczek A, Błaszak C (eds) Arthropods and hosts. LIBER Publishing House, Lublin, pp 175–184
- Rymaszewska A (2004) Comparing the sensitivity of Anaplasma phagocytophilum DNA detection in Ixodes ricinus ticks by amplifying a fragment of the epank-1 and 16S rDNA genes. Folia Med Cracov 3–4:79–85
- Rymaszewska A, Piotrowski J (2013) Use of DNA sequences for Rickettsia identification in Ixodes ricinus ticks: the first detection of Rickettsia monacensis in Poland. Microbes Infect 15:140–146
- Schorn S, Pfister K, Reulen H, Mahling M, Silaghi C (2011) Occurrence of Babesia spp., Rickettsia spp. and Bartonella spp. in Ixodes ricinus in Bavarian public parks, Germany. Parasit Vec 4:135
- Skotarczak B, Soroka M, Wodecka B (1999) The occurrence of Ixodes ricinus in the selected recreational areas in the Province of Szczecin. Part I. Wiad Parazytol 45:507–517
- Skotarczak B, Rymaszewska A, Wodecka B, Sawczuk M, Adamska M, Maciejewska A (2006) PCR detection of granulocytic Anaplasma and Babesia in Ixodes ricinus ticks and birds in west-central Poland. Ann Agric Environ Med 13:21–23
- Wodecka B (2003) Detection of DNA of Borrelia burgdorferi sensu lato in Ixodes ricinus ticks in north-western Poland. Ann Agric Environ Med 10:171–178

