Inositol
| myo-Inositol | |
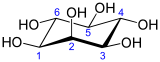  Structure du myo-inositol et numérotation de ses atomes de carbone |
|
| Identification | |
|---|---|
| Nom UICPA | cis-1,2,3,5-trans-4,6-Cyclohexanehexol |
| Synonymes |
myo-inositol |
| No CAS | (myo-inositol) |
| No ECHA | 100.027.295 |
| No CE | 201-781-2 (myo-inositol) |
| PubChem | 2958 (myo-inositol) |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H12O6 [Isomères] |
| Masse molaire[1] | 180,155 9 ± 0,007 4 g/mol C 40 %, H 6,71 %, O 53,29 %, |
| Propriétés physiques | |
| T° fusion | 225 à 227 °C |
| Solubilité | Soluble dans l'eau (250 g·L-1 à 20 °C) |
| Masse volumique | 1,752 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'inositol (C6H12O6) est une molécule organique cyclique, constituée de six atomes de carbone formant le cycle et de six groupements hydroxyles, chacun lié à un des carbones. Il existe neuf stéréoisomères possibles de l'inositol, le plus courant étant de loin le myo-inositol, qu'on trouve en abondance dans la nature et qu'on appelle simplement « inositol » par assimilation.
Le myo-inositol joue un rôle important comme messager secondaire dans les cellules eucaryotes, notamment sous forme d'inositol phosphate, de phosphatidylinositol (PI) et de phosphatidylinositol phosphate (PIP). On le trouve facilement dans l'alimentation, en particulier dans les fruits et notamment dans les melons cantaloup et dans les oranges. Il est également présent chez les plantes sous forme d'hexaphosphate, appelé acide phytique, ou de sels de celui-ci, appelés phytates ; c'est notamment le cas des céréales riches en son.
Le myo-inositol était jadis improprement appelé vitamine B7 bien qu'il ne s'agisse pas d'une vitamine car il est synthétisé par le corps humain à partir de glucose et qu'aucun syndrome de carence le concernant n'a été découvert à ce jour.
Isomères
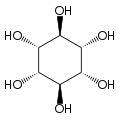
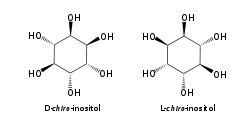
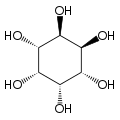
Le myo-inositol est un composé méso ayant un plan de symétrie le rendant optiquement inactif, de sorte qu'il était jadis appelé méso-inositol, terme aujourd'hui obsolète. Il existe quatre autres stéréoisomères naturels de l'inositol, bien moins abondants que le myo-inositol : il s'agit des isomères scyllo-, muco-, D-chiro- et néo- ; les isomères L-chiro-, allo-, épi- et cis- ne se rencontrent pas naturellement.
Parmi ces isomères, seuls les stéréoisomères D-chiro- et L-chiro- sont énantiomères l'un de l'autre.

|

|
|
|
| myo- | scyllo- | muco- | D-chiro- et L-chiro- |

|
|

|
|
| néo- | allo- | épi- | cis- |
Le myo-inositol ou méso-inositol est l’isomère le plus répandu de l'inositol qu’on trouve dans les vins. Cet isomère est un facteur de croissance essentiel pour beaucoup de microorganismes, en particulier pour certaines levures. Les teneurs dans le vin sont les suivantes :
- Vins blancs : de 220 à 730 mg·L-1 (moyenne de 497 mg·L-1).
- Vins rouges : de 0 à 350 mg·L-1 (moyenne de 334 mg·L-1).
À ces doses, proches du demi-gramme par litre, l'inositol est plus qu’un facteur de croissance et qu’une vitamine, c’est un important constituant du vin.
Biochimie et biologie cellulaire du myo-inositol
Le myo-inositol est naturellement présent dans la nature, on en trouve dans la sève du bouleau et dans le sirop de bouleau[2].
Cette molécule entre notamment dans la composition du phosphatidylinositol, un phospholipide de la membrane cellulaire. Après stimulation hormonale, le phosphatidylinositol est clivé en diacylglycérol (DAG) et inositol trisphosphate (IP3). Chacun de ces deux composé sert de messager secondaire pour relayer dans la cellule l'information hormonale. l'IP3 va se fixer sur des récepteurs spécifiques de la membrane du réticulum endoplasmique et provoquer une libération d'ions calcium, augmentant ainsi la concentration intracellulaire de ce cation divalent. Le calcium aura à son tour une fonction biologique, qui pourra être, par exemple, l'activation d'une protéine nécessitant une concentration élevée de calcium pour être active. Dans la fente synatpique (voir synapse), l'élévation de la concentration du calcium provoque une augmentation de la libération des catécholamines.
L'inositol et quelques-uns de ses mono et polyphosphates fonctionnent à la base de nombre de signaux primaires et secondaires. Ils sont impliqués dans une grande quantité de processus biologiques parmi lesquels :
- Insuline[3]
- Construction du Cytosquelette
- Influx nerveux (epsine)
- Régulation de la concentration intracellulaire en calcium (Ca2+)[4]
- Renforcement de la membrane cellulaire[5]
- Dégradation des graisses et diminution du cholesterol sanguin[6]
- Régulation de l'expression des gènes[7],[8]
- Syndrome de Stein-Leventhal
Utilisation en psychiatrie
Des résultats d'études portant sur l'administration d'inositol à fortes doses sur des patients souffrant de boulimie, troubles obsessionnels compulsifs, agoraphobie et dépression (tant unipolaire que bipolaire) se sont révélés prometteurs[9],[10].
Lors d'une étude en double aveugle sur 13 patients, le myo-inositol (18 grammes par jour) a réduit de façon significative les symptômes de troubles obsessionnels compulsifs, avec une efficacité équivalent aux antidépresseurs de la classe des ISRS et ce, sans le moindre effet secondaire[11].
Dans une étude en double aveugle, le myo-inositol (18 grammes par jour) s'est montré supérieur à la fluvoxamine en termes de diminution d'attaques de panique et de prévalence d'effets secondaires[9].
Dans une autre étude, en double aveugle avec placebo, des patients ont vu une amélioration significative de leurs symptômes avec 12 grammes par jour, sans la moindre modification des fonctions rénales, hépatiques ni modification de leurs paramètres hématologiques[10].
Cependant, une méta-analyse d'études relatives à l'adjonction l'inositol comme agent renforçant à un ISRS n'a pas été en mesure de montrer un avantage de celui-ci[12].
À l'instar des antidépresseurs, son effet n'est pas immédiat et la période de latence avant de voir des résultats est de l'ordre de trois à cinq semaines.
De plus anciennes recherches suggèrent que le lithium agit initialement en diminuant les concentrations en myo-inositol chez les patients bipolaires ; mais les conclusions de ces recherches manquent fortement d'arguments et ont été mises en doute[13],[14].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) H Kallio, S Ahtonen, J Raulo & RR Linko. Identification of the Sugars and Acids in Birch Sap]. Journal of Food Science, 1984, 50(1), 266 - 269. DOI 10.1111/j.1365-2621.1985.tb13328.x
- Larner J, « D-chiro-inositol--its functional role in insulin action and its deficit in insulin resistance », Int J Exp Diabetes Res, vol. 3, no 1, , p. 47–60 (PMID 11900279, PMCID 2478565, DOI 10.1080/15604280212528)
- Gerasimenko, Julia V; et al; “Bile Acids Induce Ca2+ Release from Both the Endoplasmic Reticulum and Acidic Intracellular Calcium Stores through Activation of Inositol Trisphosphate Receptors and Ryanodine Receptors”; Journal of Biological Chemistry; December 29, 2006; Volume 281: Pp 40154-40163.
- Kukuljan M, Vergara L, Stojilkovic SS, « Modulation of the kinetics of inositol 1,4,5-trisphosphate-induced [Ca2+]i oscillations by calcium entry in pituitary gonadotrophs », Biophysical Journal, vol. 72, no 2 Pt 1, , p. 698–707 (PMID 9017197, PMCID 1185595, DOI 10.1016/S0006-3495(97)78706-X, Bibcode 1997BpJ....72..698K)
- Rapiejko PJ, Northup JK, Evans T, Brown JE, Malbon CC, « G-proteins of fat-cells. Role in hormonal regulation of intracellular inositol 1,4,5-trisphosphate », The Biochemical Journal, vol. 240, no 1, , p. 35–40 (PMID 3103610, PMCID 1147372)
- Shen, X., H Xiao, R Ranallo, WH Wu et C Wu, « Modulation of ATP-dependent chromatin-remodeling complexes by inositol polyphosphates », Science, vol. 299, no 5603, , p. 112–4 (PMID 12434013, DOI 10.1126/science.1078068)
- Steger, D. J., ES Haswell, AL Miller, SR Wente et EK O'Shea, « Regulation of chromatin remodelling by inositol polyphosphates », Science, vol. 299, no 5603, , p. 114–6 (PMID 12434012, PMCID 1458531, DOI 10.1126/science.1078062)
- (en) Palatnik A, Frolov K, Fux M, Benjamin J, « Double-blind, controlled, crossover trial of inositol versus fluvoxamine for the treatment of panic disorder », Journal of Clinical Psychopharmacology, vol. 21, no 3, , p. 335–339 (PMID 11386498, DOI 10.1097/00004714-200106000-00014)
- (en) Levine J, Barak Y, Gonzalves M, Szor H, Elizur A, Kofman O, Belmaker RH., « Double-blind, controlled trial of inositol treatment of depression », American Journal of Psychiatry, vol. 152, no 5, , p. 792–794 (PMID 7726322)
- (en) Fux M, Levine J, Aviv A, Belmaker RH, « Inositol treatment of obsessive-compulsive disorder », American Journal of Psychiatry, vol. 153, no 9, , p. 1219–21 (PMID 8780431)
- (en) Taylor MJ, Wilder H, Bhagwagar Z, Geddes J, « Inositol for depressive disorders », Cochrane Database Syst Rev, no 2, , p. CD004049 (PMID 15106232, DOI 10.1002/14651858.CD004049.pub2)
- P. H. Silverstone, B. M. McGrath et H. Kim, « Bipolar disorder and myo-inositol: A review of the magnetic resonance spectroscopy findings », Bipolar Disorders, vol. 7, no 1, , p. 1–10 (PMID 15654927, DOI 10.1111/j.1399-5618.2004.00174.x)
- Harwood, AJ, « Lithium and bipolar mood disorder: the inositol-depletion hypothesis revisited », Molecular Psychiatry, vol. 10, , p. 117–126 (DOI 10.1038/sj.mp.4001618, lire en ligne)
