α-amylase
| α-Amylase | ||
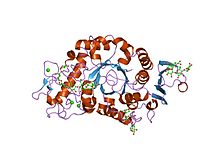
 Structure d'une α-amylase pancréatique humaine (PDB 1HNY) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | AMY | |
| N° EC | 3.2.1.1 | |
| Code ATC | A09 | |
| Gène AMY1A — α-Amylase 1A (salivaire) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 768 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY1B — α-Amylase 1B (salivaire) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 768 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY1C — α-Amylase 1C (salivaire) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 768 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY2A — α-Amylase 2A (pancréatique) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 707 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène AMY2B — α-Amylase 2B (pancréatique) | ||
| Homo sapiens | ||
| Locus | 1p21.1 | |
| Masse moléculaire | 57 710 Da[1] | |
| Nombre de résidus | 511 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
L'α-amylase (ou diastase ou takadiastase) est la toute première enzyme qui fut découverte en 1833 par Anselme Payen et Jean-François Persoz[2].
L'α-amylase (EC ) est une enzyme digestive classée comme glycosidase (enzyme qui hydrolyse les polysaccharides). C'est un constituant du suc pancréatique et de la salive, requis pour le catabolisme des glucides à longue chaîne (comme l'amidon) en unités plus petites.
Elle est également synthétisée dans les fruits de beaucoup de plantes durant leur maturation (c'est ce qui rend leur goût si doux et sucré), et aussi pendant la germination des graines. L'amylase est entre autres responsable de la production de malt.
| Pfam | PF07821 |
|---|---|
| InterPro | IPR012850 |
Types[modifier | modifier le code]
Il y a deux iso-enzymes de l'amylase : l'amylase salivaire (ou amylase 1 ou ptyaline[3]) et l'amylase pancréatique (ou amylase 2). Elles se comportent différemment en focalisation isoélectrique, et peuvent être séparées en testant par les anticorps monoclonaux spécifiques.
Mécanisme d'action[modifier | modifier le code]
L'α-amylase brise les liaisons α(1→4)glycosidiques à l'intérieur des chaînes de l'amylose et de l'amylopectine pour donner des molécules de maltose (disaccharides de α-glucose).
Elle possède un site de liaison donc participe à l'élaboration de la pellicule acquise exogène. Elle se lie avec affinité au S. viridans ce qui conduit à sa clairance ou à son adhésion selon que l'amylase est en solution ou absorbée à la surface dentaire. L'amylase liée à une bactérie conserve environ 50 % de son activité enzymatique. La bactérie liée à l'amylase peut donc fermenter l'acide glutamique que celle-ci produit en acide organique.
Les acide aminés du site de réaction sont l'aspartate 197, le glutamate 233, l'aspartate 300[4].

| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
Génétique[modifier | modifier le code]
Chez l'Homme, toutes les iso-amylases sont liées au chromosome 1q21.
L'enzyme peut être détectée en la mélangeant à son substrat pour obtenir un ou plusieurs produits. Dans ce cas, cette enzyme possède un substrat qui est l'amidon. Ces produits seront le maltose, diholoside réducteur qui pourra être détecté grâce à la liqueur de Fehling.
Son gène s'appelle AMY2A[5].
Séquence chez l'humain[modifier | modifier le code]
MKFFLLLFTIGFCWAQYSPNTQQGRTSIVHLFEWRWVDIALECERYLAPKGFGGVQVSPPNENVAIYNPF RPWWERYQPVSYKLCTRSGNEDEFRNMVTRCNNVGVRIYVDAVINHMCGNAVSAGTSSTCGSYFNPGSRD FPAVPYSGWDFNDGKCKTGSGDIENYNDATQVRDCRLTGLLDLALEKDYVRSKIAEYMNHLIDIGVAGFR LDASKHMWPGDIKAILDKLHNLNSNWFPAGSKPFIYQEVIDLGGEPIKSSDYFGNGRVTEFKYGAKLGTV IRKWNGEKMSYLKNWGEGWGFVPSDRALVFVDNHDNQRGHGAGGASILTFWDARLYKMAVGFMLAHPYGF TRVMSSYRWPRQFQNGNDVNDWVGPPNNNGVIKEVTINPDTTCGNDWVCEHRWRQIRNMVIFRNVVDGQP FTNWYDNGSNQVAFGRGNRGFIVFNNDDWSFSLTLQTGLPAGTYCDVISGDKINGNCTGIKIYVSDDGKA HFSISNSAEDPFIAIHAESKL[6]
Pathologies[modifier | modifier le code]
Des niveaux anormaux d'amylase ont été trouvés dans des cas de :
- traumatismes salivaires (incluant les problèmes liés à l'intubation pendant une anesthésie)
- oreillons (provoquant l'inflammation des glandes salivaires)
- pancréatite (à cause des dommages créés sur les cellules productrices d'amylase)
- problèmes rénaux (à cause d'une sécrétion réduite).
En général, une quantité d'enzymes plus de 10 fois supérieure à la normale est un des symptômes de la pancréatite. Lorsque la quantité est de l'ordre de 5 à 10 fois le taux normal, cela peut indiquer des problèmes duodénaux ou rénaux. Parfois, on peut trouver une faible augmentation d'amylase dans la salive sans que ce soit pathogène.
Séquence[modifier | modifier le code]
Les cinq α-amylases humaines comportent chacune 496 acides aminés. Les différences entre elles sont très petites (les amylases 1A, 1B et 1C sont identiques).
Notes et références[modifier | modifier le code]
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Payen et Persoz, « Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels », Annales de chimie et de physique, 2e série, t. 53, 1833, pp. 73-92, consultable sur Google Books
- Éditions Larousse, « Définitions : ptyaline - Dictionnaire de français Larousse », sur www.larousse.fr (consulté le )
- G. D. Brayer, Y. Luo et S. G. Withers, « The structure of human pancreatic alpha-amylase at 1.8 A resolution and comparisons with related enzymes », Protein Science: A Publication of the Protein Society, vol. 4, no 9, , p. 1730–1742 (ISSN 0961-8368, PMID 8528071, PMCID 2143216, DOI 10.1002/pro.5560040908, lire en ligne, consulté le )
- « UniProt », sur www.uniprot.org (consulté le )
- « pancreatic alpha-amylase precursor [Homo sapiens] - Protein - NCBI », sur www.ncbi.nlm.nih.gov (consulté le )
Article connexe[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- Amylase sur la librairie de molécules