Synthèse organique par photofragmentation
La synthèse par photofragmentation est une technique de synthèse chimique dans laquelle des liaisons intramoléculaires de faibles énergies sont rompues par des photons. Cette technique permet d'ajouter un groupe fonctionnel sur un carbone non-activé à l'aide d'un radical libre. Les réactions les plus communes sont la réaction de Barton, la réaction de Hofmann-Loffler-Freytag, et la réaction hypoalithe.
Les réactions de synthèse par photofragmentation peuvent être utilisés pour introduire un groupement fonctionnel sur des stéroïdes, des alcaloïdes ou encore des terpénoïdes lorsque d'autres techniques de synthèse plus conventionnelles ne sont pas adaptées[1].
Histoire[modifier | modifier le code]
Dans l'histoire, de nombreuses recherches ont conduit à la découverte du phénomène de photofragmentation ainsi que son utilisation dans de nombreuses applications. Étant un sous-domaine de la photochimie, le développement de la synthèse par photofragmentation est intimement lié à celui de la photochimie. Mais c'est au XIXe siècle que la photochimie se développe réellement. Dès 1834, Hermarin Trommsdorff nota que l'exposition au soleil provoquait un jaunissement de la santonine et un éclatement de son cristal. Trommsdorff s'intéressa également à la dépendance au type de lumière et détermina que les lumières bleues et violettes étaient à l'origine de ces réactions. Trommsdorff et Heldt affirmèrent que les santonines blanches et jaunes étaient des isomères.
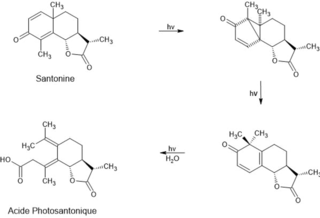
Une vingtaine d'années plus tard, Fausto Sestini synthétisa la photosantonine et l'acide photosantinique en irradiant de la santonine respectivement dans des solutions aqueuses d'éthanol et d'acide acétique (Figure 1). Après avoir rencontré Sestini, Stanislao Cannizaro s'intéressa à la photosantonine et découvrit à l'aide de ses collègues l'acide isophotosantonique[2].
En 1881, William Perkin observe la première stéréoisomérisation cis-trans d'oléfine. C'est une des photoréactions les plus génériques sur un oléphine. Il étudia de l'acide 2-alcoxycinnamique obtenu à partir de coumarine. Il observa une transformation de plusieurs "α-acides"en "isomères β" sous l'effet de la lumière solaire. En utilisant des solutions colorées comme filtres, il affirma que la réaction est provoquée par de la lumière violette ou ultraviolette. Toutefois, ces réactions étaient très lentes[3].
Une dizaine d'années plus tard Carl Liebermann observa des stéréomutations cis-trans similaires sur divers acides insaturés, dont l'acide cinnamique. Durant les études qu'il entreprit son équipe et lui découvrirent que la cinétique de stéréoisomerisation cis-trans d'un dérivé éthylénique pouvait être grandement améliorée en ajoutant de l'iode comme stabilisateur. Toutefois, Liebermann échoua à provoquer de tels effets sur des acides non-aromatiques insaturés. Johannes Wislicenus montra que le brome avait un effet sur ceux-ci. Il réussit à transformer de l'acide isocrotonique en acide crotonique, de l'acide angélique en acide tiglique (figure 2) et de l'acide maléique en acide fumarique en les irradiant dans une solution aqueuse de brome[2].

Principe[modifier | modifier le code]
La photodissociation est un procédé lors duquel une liaison moléculaire est brisée du fait de l'absorption d'un ou de plusieurs photons. Lorsqu'une molécule absorbe un photon, l'énergie du rayonnement électromagnétique est alors convertie en énergie interne à la molécule. Si cette énergie est supérieure à l'énergie de liaison de la liaison la plus faible, alors la molécule se brise. Une photofragmentation suit l'équation générale suivante :
AB + nphoton(h𝛎) → (AB)* → A + B[4]
oú l'on considère la photofragmentation d'une molécule AB en molécule ou atome A et B, nphoton (h𝛎) est le nombre de photons d'énergie h𝛎 absorbé et (AB)* représente un état de transition excité.
Pour les molécules formées par des liaisons covalentes, l'énergie de rupture D0 peut atteindre plusieurs électron-volts.
ClNO (D0 = 1,62 eV)
H2O2 (D0 = 2,12 eV)
H2O (D0 = 5,11 eV)
Du fait de la grande énergie des liaisons covalentes, leur rupture nécessite un photon ultraviolet ou plusieurs photons infrarouges.
L'énergie du photon incident est utilisée pour rompre la liaison A–B et l'excès est dispersé en énergie de translation E et en énergie interne des atomes ou molécules ainsi produites (comprenant les énergies vibrationnelles, rotationnelles et électroniques)[4].
Eexcès = Ephoton - D0 = Etranslation + Einterne
La photofragmentation permet d'ajouter des groupes fonctionnels sur des carbones non-activés en y additionnant des radicaux libres. Les radiations électromagnétiques permettent de former ces radicaux en brisant des liaisons peut énergétiques incluant des hétéroatomes telles que les liaisons C-N, C-O, O-N, O-Cl, O-I, par exemple[1].
Exemples de domaines d’application[modifier | modifier le code]
Réaction d'Hofmann Löffler Freytag[modifier | modifier le code]
De nombreuses réactions utilisées en synthèse organique impliquent le processus de photofragmentation, comme la réaction d’Hofmann Löffler Freytag ou la réaction de Barton. Dans la réaction d’Hofmann Löffler Freytag employant de la photofragmentation, une amine tertiaire halogénée est transformée en amine secondaire par irradiation puis cyclisée à l'aide d’une base[5].

Ici, l’amine est dans un premier temps protonée à l’aide d'un acide fort et la rupture homolytique de la liaison amine halogéné N-X, se fait par irradiation par lumière ultraviolette donc par photofragmentation plus précisément par photolyse, ce qui donne deux radicaux (un radical de l'halogène et l’autre de l’amine)[6]. Le radical ammonium va ensuite subir une cyclisation intramoléculaire en 1,5 sous l’influence d’une base et de l'halogène radicalaire, produisant alors l'amine cyclique[7].
La réaction d’Hofmann Löffler Freytag par photofragmentation peut être utilisée pour une alkylation en faisant réagir un halogène avec l’amine, prenant l’exemple de la formation de la molécule de nicotine[8].
Ici, une liaison amine-brome est cassée pour former une liaison amine-carbone :

Dans cette réaction, la photofragmentation joue un rôle majeur dans la stéréochimie, car elle permet de casser la liaison amine-halogène aisément sans devoir changer la température de la solution, ce qui favorise la cyclisation des différentes liaisons possibles. De plus, cette réaction est utile pour sa capacité à attaquer les δ-hydrogéné[9].
Réaction de Barton[modifier | modifier le code]
La réaction de Barton correspond à une réaction chimique impliquant la photofragmentation d’un nitrite d’alkyle pour former un alcool δ- nitroso. Ce processus implique une rupture homolytique RO-NO à l’aide de photons avec suffisamment d’énergie, afin de former deux fragments radicalaires. Le radical alkoxyle R-O• formé, réagit très vite avec un δ-hydrogène formant un radical alkyle, qui va ensuite réagir avec le radical nitrosyle O=N• formé précédemment pour produire un alcool δ- nitroso. Le composé obtenu subit une tautomérisation entraînant la formation d’une oxime[10],[11].
Une lumière de faible puissance (longueur d'onde maximale : 352 nm) et une lumière LED UV (longueur d'onde maximale : 365 nm) suffisent comme source de lumière pour cette réaction[12].

La réaction de Barton est utilisée dans différents domaines, principalement dans le développement de la chimie des stéroïdes, mais également dans différentes voies de synthèse d'intérêt pharmaceutique, notamment pour la synthèse d’antibiotiques[13].
L’acétate d’aldostérone, une hormone stéroïdienne, est synthétisé à partir de l’acétate de corticostérone (1). Ce dernier est traité avec de la pyridine sèche dans un excès de chlorure de nitrosyle afin d’obtenir un nitrite d'acétate de corticostérone (2). Sous irradiation, celui-ci subit une photofragmentation pour obtenir l'oxime d’acétate d’aldosterone (3). L’oxime obtenue est traité avec d'autres composés pour enfin obtenir l'acétate d'aldostérone (4) souhaitée[14]. Le rendement de cette réaction est uniquement de 20%, cependant, quantitativement celle-ci est la plus rentable car permet d’obtenir 60 grammes d’acétate d’aldostérone tandis que d’autres synthèses testées permettent uniquement d’obtenir quelques milligrammes, donc la photochimie joue un rôle important dans la synthèse de cette hormone[15].

Biaryls[modifier | modifier le code]
Les biaryls sont des composés d'intérêt médical et pharmaceutique de nombreuses voies de synthèses sont donc connues pour la production de ceux-ci[16].



La plupart des biaryls sont synthétisés par des méthodes catalytiques et stoechiométriques, mais peu de méthodes de synthèse par photofragmentation sont connues. En effet le mécanisme général de la synthèse de ces biaryls par photofragmentation est la création d’une liaison aryl-aryle à partir d'haloarènes. Les rendements de ces synthèses par photofragmentation dépendent du solvant, des substituants du réactif de départ, du réacteur utilisé et du type d'irradiation utilisé (UVA, UVB ou UVC).
Synthèse des biaryls par photofragmentation à partir des N-aroyl-sulfonamides avec un substituant N-alkyl[16]

Pour obtenir un meilleur rendement, le N-aroyl-sulfonamides a été utilisé avec un substituant N-alkyl R: CH2Ph et de l’acétate d'éthyle comme solvant.
Quant à l’équipement photochimique, il est préférable d’utiliser un réacteur à flux (système ouvert) plutôt qu’un réacteur chimique classique (système fermé).
De plus, une irradiation du composé N-aroyl-sulfonamides par UVB ou UVC à 300 nm permet d’obtenir d'excellents rendements de synthèse pour les biaryls.
Notes et références[modifier | modifier le code]
- Biswanath Dinda, Essentials of pericyclic and photochemical reactions, (ISBN 978-3-319-45934-9 et 3-319-45934-1, OCLC 963932190, lire en ligne)
- (en) Heinz D. Roth, « The Beginnings of Organic Photochemistry », revue scientifique, (lire en ligne [PDF])
- A. Berthoud et Ch. Urech, « Isomérisation photochimique de l'acide allocinnamique en présence de l'iode », Journal de Chimie Physique, vol. 27, , p. 291–306 (ISSN 0021-7689, DOI 10.1051/jcp/1930270291, lire en ligne, consulté le )
- Reinhard Schinke, Photodissociation dynamics : spectroscopy and fragmentation of small polyatomic molecules, Cambridge University Press, (ISBN 0-521-38368-4, 978-0-521-38368-4 et 0-521-48414-6, OCLC 25026200, lire en ligne).
- (en) « Organic Mechanisms Online », sur orgmech.co.uk (consulté le ).
- (en) Stefano Parisotto, Emanuele Azzi, Alberto Lanfranco et Polyssena Renzi, « Recent Progresses in the Preparation of Chlorinated Molecules: Electrocatalysis and Photoredox Catalysis in the Spotlight », Reactions, vol. 3, no 2, , p. 233–253 (ISSN 2624-781X, DOI 10.3390/reactions3020018, lire en ligne, consulté le )
- (en) « Hofmann-Loeffler-Freytag reaction », sur Vive Chemistry, (consulté le ).
- (en) Shunsuke Chiba et Hui Chen, « sp 3 C–H oxidation by remote H-radical shift with oxygen- and nitrogen-radicals: a recent update », Org. Biomol. Chem., vol. 12, no 24, , p. 4051–4060 (ISSN 1477-0520 et 1477-0539, DOI 10.1039/C4OB00469H, lire en ligne, consulté le )
- (en) P.G. Gassman et D.C. Heckert, « The synthesis of 2-azabicyclo[2.2.1]heptanes by the Hofmann-Löffler-Freytag reaction », Tetrahedron, vol. 21, no 10, , p. 2725–2734 (DOI 10.1016/S0040-4020(01)98358-9, lire en ligne, consulté le )
- (en) « Barton Reaction », dans Comprehensive Organic Name Reactions and Reagents, John Wiley & Sons, Inc., (ISBN 978-0-470-63885-9, DOI 10.1002/9780470638859.conrr055, lire en ligne), conrr055
- « Barton Reaction », dans Name Reactions in Organic Synthesis, Foundation Books, (ISBN 978-81-7596-829-5, DOI 10.1017/upo9788175968295.013, lire en ligne), p. 43–44
- (en) Atsushi Sugimoto, Takahide Fukuyama, Yukihito Sumino et Makoto Takagi, « Microflow photo-radical reaction using a compact light source: application to the Barton reaction leading to a key intermediate for myriceric acid A », Tetrahedron, vol. 65, no 8, , p. 1593–1598 (ISSN 0040-4020, DOI 10.1016/j.tet.2008.12.063, lire en ligne, consulté le )
- (en) Gholam Hossein Hakimelahi, Pai-Chi Li, Ali A. Moosavi-Movahedi et Jamshid Chamani, « Application of the Barton photochemical reaction in the synthesis of 1-dethia-3-aza-1-carba-2-oxacephem: a novel agent against resistant pathogenic microorganisms », Organic & Biomolecular Chemistry, vol. 1, no 14, , p. 2461 (ISSN 1477-0520 et 1477-0539, DOI 10.1039/b304167k, lire en ligne, consulté le )
- (en) Harold Finegold, « STRUCTURE OF O,O'-DIETHYL METHYLPHOSPHONOTHIOATE AND CONJUGATIVE PROPERTIES OF THE P[UNK]S BOND », Journal of the American Chemical Society, vol. 82, no 10, , p. 2641–2643 (ISSN 0002-7863 et 1520-5126, DOI 10.1021/ja01495a063, lire en ligne, consulté le )
- (en) D. H. R. Barton, « The Invention of Chemical Reactions », Aldrichimica Acta, Vol 23, No. 1,
- (en) Pablo Wessig et Saskia Krebs, « N‐Aroylsulfonamide‐Photofragmentation (ASAP)‐A Versatile Route to Biaryls », European Journal of Organic Chemistry, vol. 2021, no 46, , p. 6367–6374 (ISSN 1434-193X et 1099-0690, DOI 10.1002/ejoc.202100955, lire en ligne, consulté le )
- (en) Shuo Yuan, Junbiao Chang et Bin Yu, « Construction of Biologically Important Biaryl Scaffolds through Direct C–H Bond Activation: Advances and Prospects », Topics in Current Chemistry, vol. 378, no 2, , p. 23 (ISSN 2365-0869 et 2364-8961, DOI 10.1007/s41061-020-0285-9, lire en ligne, consulté le ).

