QSER1
La protéine 1 riche en sérine de glutamine ou QSER1 est une protéine codée par le gène QSER1[1].
La fonction de cette protéine est actuellement inconnue. QSER1 a un alias, FLJ21924[1].
Gène
Emplacement
Le gène QSER1 se trouve sur le bras court du chromosome 11 (11p13), débutant à 32 914 792 pb et se terminant à 33 001 816 pb. Il a une longueur de 87 024 pb. Il est situé entre les gènes DEPDC7 et PRRG4 et à 500 000 pb en aval du gène de Wilms Tumor 1 (WT1), impliqué dans de multiples pathologies[1],[2].
L'homologie
Orthologues
QSER1 est hautement conservé dans la plupart des espèces du clade Chordata. Des orthologues ont été trouvés chez des primates, des oiseaux, des reptiles, des amphibiens et des poissons aussi loin que le coelacanthe, qui avait divergé il y a 414,9 millions d'années[1],[2]
Paralogues
QSER1 a un paralogue chez l'homme, riche en proline 12 ou PRR12. PRR12 se trouve sur le chromosome 9 à 9q13.33, qui n'a pas de fonction connue. Le PRR12 est présent dans la plupart des espèces de chordés aussi loin que le coelacanthe[3]. L'événement de duplication est probablement survenu dans la lignée des accords près de la divergence du coelacanthe. PRR12 et QSER1 contiennent tous deux le domaine DUF4211 conservé près des extrémités 3 'des gènes[1],[3] .
mRNA
Facteurs promoteurs et de transcription
La région promotrice de QSER1 a une longueur de 683 pb et se trouve sur le chromosome 11 entre 32 914 224 pb et 32 914 906. Il existe un certain chevauchement entre la région promotrice et la 5 'UTR de QSER1. Les facteurs de transcription prévus avec conservation comprennent (sans s'y limiter) EGR1, p53, E2F3, E2F4, PLAG1, NeuroD2, Myf5, IKAROS1, SMAD 3, KRAB, MZF1 et c- Myb[4].
Expression
Expression normale
L'expression de QSER1 est observée à des niveaux inférieurs à 50% dans de nombreux tissus. Cependant, une expression notable est observée dans le muscle squelettique, l'annexe, les ganglions du trijumeau, les pédoncules du cervelet, les pons, la moelle épinière, le ganglion ciliaire, le globus pallidus, le noyau sous - thalamique, le ganglion de la racine dorsale, le foie fœtal, la glande surrénale, l'ovaire, le ganglion de la tête, le nœud auriculo - ventriculaire, la peau, l'hypophyse, la langue, les précurseurs de l'érythroïde et les amygdales[5],[6].

Expression différentielle
Une diminution notable de l'expression de QSER1 a été observée dans les cellules mésangiales rénales en réponse à un traitement avec du glucose à 25 mM. Cette condition a été étudiée, car l'expression différentielle de gènes impliqués dans la régulation du cycle cellulaire avait été notée dans ces cellules en réponse à des taux de glucose élevés observés avec le diabète sucré[7],[8]. Une autre étude a mis en évidence une surexpression de QSER1 dans les cardiomyopathies pathologiques. Cette condition est associée à une altération de l'expression des gènes impliqués dans les réponses immunitaires, la signalisation, la croissance et la prolifération cellulaire ainsi que dans l'infiltration de lymphocytes B.[9],[10]
L'expression différentielle de QSER1 est observée dans plusieurs états cancéreux. La surexpression de QSER1 a été notée dans le lymphome de Burkitt[5]. L'expression QSER1 augmente également avec l'augmentation du score de Gleason (stades plus avancés) du cancer de la prostate[11]. Dans une étude sur la réponse du cancer du sein à la chimiothérapie au paclitaxel et au fluorouracile-doxorubicine-cyclophosphamide, il a été noté que les lignées de cancer du sein présentant des taux plus élevés de QSER1 étaient plus susceptibles de répondre au traitement que celles présentant une sous-expression de QSER1[12]. On a également noté une plus grande expression de QSER1 dans les cellules épithéliales mammaires de lignées cellulaires immortalisées par rapport aux cellules épithéliales mammaires de lignées cellulaires à durée de vie limitée[13].
3 'UTR
Plus de 20 boucles de tige sont prévues dans la 3 'UTR de QSER1. 16 boucles de tige se trouvent dans les premiers 800 pb de 3 'UTR.[14] La 3 'UTR est presque entièrement conservée chez les mammifères et moins conservée chez d'autres organismes[15].
Protéine
Les propriétés générales

La protéine QSER1 a une longueur de 1735 acides aminés[16]. La composition du peptide est significativement élevée en sérine et en glutamine: 14,7% de résidus de sérine et 8,9% de glutamine[17].
Conservation
La protéine QSER1 est hautement conservée chez les espèces de chordé. Le tableau ci-dessous présente des informations sur les orthologues de protéines.
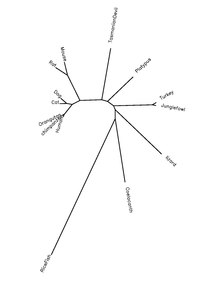
| Nom du genre et de l'espèce | Nom commun | Numéro d'accession de la protéine[18] | Identité de séquence en protéine humaine[18] |
|---|---|---|---|
| Homo sapiens | Humains | NP_001070254.1 | |
| Pan troglodytes | Chimpanzé | XP_508354.3 | 99% |
| Macaca Mulâta | Macaque rhésus | NP_001244647.1 | 98% |
| Callithris jacchus | Ouistiti | XP_002755192.1 | 96% |
| Ailuropoda melanoleuca | Panda géant | XP_002917539.1 | 90% |
| Loxodonta africana | éléphant | XP_003412344.1 | 88% |
| Mus musculus | Souris | NP_001116799.1 | 81% |
| Monodelphis domestica | Opossum | XP_001368629.1 | 71% |
| Ornithorhynchus anatinus | Ornithorynque | XP_001506659.2 | 75% |
| Taeniopygia guttata | Zèbre | XP_002195876.1 | 69% |
| Gallus gallus | poulet | NP_001186343.1 | 69% |
| Anolis carolinensis | Caroline anole (lézard) | XP_003214747.1 | 62% |
| Takifugu rubripes | Poisson-globe japonais | XP_003977915.1 | 48% |
| Latimeria chalumnae | Coelacanthe | N / A | 62% |
Domaines et motifs

La protéine QSER1 contient deux domaines hautement conservés que l'on trouve non seulement dans QSER1, mais également dans d'autres produits protéiques. Ceux-ci comprennent le domaine PHA02939 de l'acide aminé 1380-1440 et le domaine DUF4211 de l'acide aminé 1522-1642[19],[20]. La localisation nucléaire était prédite par pSORT. Cette propriété a été conservée du QSER1 humain au coelacanthe QSER1. Plusieurs signaux de localisation nucléaire conservés ont également été prédits dans la protéine QSER1 par pSORT.[21]
Structure
Les prévisions de la structure de la protéine QSER1 indiquent que celle-ci contient de nombreuses hélices alpha[22],[23],[24]. NCBI cBLAST a prédit la similarité structurelle entre la protéine QSER1 et la chaîne ARN Polymérase II A de Schizosaccharomyces pombe (levure à fission). Les deux régions de similarité se situent entre les acides aminés 56-194 et 322-546[23]. Cette première région (56-194) est une région régulatrice d'ARN polymérase II humaine et de levure contenant plusieurs répétitions de la séquence YSPTSPSYS. La phosphorylation des résidus de sérine dans cette région régule la progression à travers les étapes de la transcription des gènes[25]. Une structure 3D a été fournie pour cette région. La région structurellement similaire se trouve à l'extérieur de la molécule de protéine et fait partie de la fente de liaison à l'ADN.
Phyre2 prédit une autre similitude structurelle avec une protéine de liaison à l'ARN polymérase virale[24]. Cette structure se trouve à la toute fin de la protéine entre les acides aminés 1671-1735. La structure a une longue région d'hélices alpha qui ont également été prédites par SDSC Biology Workbench PELE. Une image de la région structurellement similaire et l'alignement de la séquence sont montrés à droite. Les régions précédant le domaine structurellement similaire identifié montrent deux autres hélices alpha prédites avec une confiance élevée[24].
Modifications post-traductionnelles
Phosphorylation

Il existe 12 sites de phosphorylation confirmés sur la protéine QSER1. Huit sont des phosphosérines, une phosphotyrosine et trois phosphothréonines. Il a été démontré que trois de ces sites étaient phosphorylés par ATM et ATR en réponse à des dommages à l'ADN.[26] 123 autres sites de phosphorylation possibles ont été prédits à l'aide de l'outil ExPASy NetPhos[27].
SUMOylation
L'interaction de la protéine QSER1 avec SUMO a été notée dans de nombreuses études portant sur le protéome[28],[29]. Des sites SUMOylation prévus ont été trouvés dans la protéine QSER1. Des sites de SUMOylation hautement conservés apparaissent avec la séquence MKMD à l'acide aminé 794, VKIE à 1057, VKTG à 1145, LKSG à 1157, VKQP à 1487 et VKAE à 1492[30].

Les interactions
ATM / ATR
La phosphorylation de QSER1 au niveau de trois résidus de sérine, S1228, S1231 et S1239, par ATM et ATR en réponse à des dommages à l'ADN a été découverte dans une étude à l'échelle du protéome[26].
SUMO
L'interaction de QSER1 avec SUMO a été confirmée par plusieurs études[28],[29]. Le rôle de SUMOylation dans la fonction QSER1 n'est pas clair. Cependant, il peut exister un lien entre QSER1 et SUMO en réponse au stress du réticulum endoplasmique (souvent causé par une accumulation de protéines mal repliées). Dans une étude sur le stress ER, QSER1 a été étiqueté comme un gène de réponse au stress ER avec une expression modifiée[31]. De plus, dans une étude sur la SUMOylation en réponse à une accumulation de protéines mal repliées et à un stress ER, QSER1 a été révélé être un interactant SUMO dans cette situation[28]. Tout lien entre ces deux activités est non étudié et non confirmé.
ARN polymérase II
L'interaction directe de QSER1 avec l'ARN polymérase II a été mise en évidence dans une étude réalisée par Moller et al. Il a été démontré que l'interaction se produisait avec la sous-unité de l'ARN polymérase II dirigée par l'ADN, RPB1, de l'ARN polymérase II pendant la mitose et l'interphase. La colocalisation / interaction de QSER1 s'est révélée dans la région régulatrice de RPB1 avec 52 répétitions d'heptapeptide (YSPTSPSYS)[25].
NANOG et TET1
L'interaction entre la protéine homéobox NANOG et la méthylcytosine dioxygénase 1 (TET1) s'est révélée être importante pour établir la pluripotence lors de la génération de cellules souches pluripotentes induites. La protéine QSER1 interagit à la fois avec NANOG et TET1[32].
Ubiquitine
Il a été démontré que QSER1 interagissait avec l'ubiquitine dans deux études de substrat portant sur le protéome[33],[34]. Les détails spécifiques de cette interaction n'ont pas été étudiés.
Pathologie
Une expression altérée de QSER1 est notée dans la cardiomyopathie pathologique, le lymphome de Burkitt, le cancer de la prostate et certains cancers du sein mentionnés ci-dessus[4],[5],[9]. NCBI AceView répertorie plusieurs mutations associées à d'autres pathologies, dont une suppression de huit paires de bases et de 13 paires de bases dans QSER1 associée à un léiomyosarcome de l'utérus et une différence de 57 paires de bases dans un neuroblastome. Sont également énumérés de nombreux variants d'épissure avec des extrémités 5 'et / ou 3' tronquées, souvent observés dans des conditions cancéreuses[35]. En outre, selon la base de données OMBI de NCBI, de multiples pathologies sont associées à des altérations dans la région 11p13 et peuvent donc impliquer QSER1[36]. Il s'agit notamment de la vitréorétinopathie exsudative 3[37], candidose familiale 3[38], épilepsie d'origine centrale[39], et d'une surdité autosomique récessive 51[40]. QSER1 a également été noté comme gène de susceptibilité à la maladie de Parkinson[31] .
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « QSER1 » (voir la liste des auteurs).
- « NCBI QSER1 Gene »
- « Genecards QSER1 »
- « NCBI PRR12 Gene »
- « Genomatix Tools: El Dorado »
- « NCBI GeoProfiles db; QSER1 GDS596 »
- « NCBI EST Profile db; QSER1 »
- « High glucose-altered gene expression in mesangial cells. Actin-regulatory protein gene expression is triggered by oxidative stress and cytoskeletal disassembly », The Journal of Biological Chemistry, vol. 277, no 12, , p. 9707–12 (PMID 11784718, DOI 10.1074/jbc.M109172200, lire en ligne)
- « NCBI GeoProfiles db; QSER1 GDS1891 »
- « Transcriptional profile of isoproterenol-induced cardiomyopathy and comparison to exercise-induced cardiac hypertrophy and human cardiac failure », BMC Physiology, vol. 9, no 23, , p. 23 (PMID 20003209, PMCID 2799380, DOI 10.1186/1472-6793-9-23)
- « NCBI GeoProfiles db; QSER1 GDS3596 »
- « NCBI GeoProfiles db; QSER1 GDS1746 »
- « NCBI GeoProfiles db; QSER1 GDS3721 »
- « NCBI GeoProfiles db; QSER1 GDS2810 »
- « mfold »
- « SDSC Biology Workbench ClustalW »
- « NCBI QSER1 Protein »
- « SDSC Biology Work Bench; SAPS »
- « NCBI National Center for Biotechnology Information »
- « NCBI Conserved domains db; DUF4211 »
- « NCBI Conserved domains db; PHA02939 »
- « pSORT II Prediction »
- « SDSC Biology Workbench; PELE »
- « NCBI cBLAST; QSER1 »
- « Phyre2 »
- « Proteomic analysis of mitotic RNA polymerase II reveals novel interactors and association with proteins dysfunctional in disease », Molecular & Cellular Proteomics, vol. 11, no 6, , M111.011767 (PMID 22199231, PMCID 3433901, DOI 10.1074/mcp.M111.011767, lire en ligne)
- « ATM and ATR substrate analysis reveals extensive protein networks responsive to DNA damage », Science, vol. 316, no 5828, , p. 1160–6 (PMID 17525332, DOI 10.1126/science.1140321, Bibcode 2007Sci...316.1160M, lire en ligne)
- « ExPASy NetPhos »
- « Comparative proteomic analysis identifies a role for SUMO in protein quality control », Science Signaling, vol. 4, no 178, , rs4 (PMID 21693764, DOI 10.1126/scisignal.2001484, lire en ligne)
- « Purification and identification of endogenous polySUMO conjugates », EMBO Reports, vol. 12, no 2, , p. 142–8 (PMID 21252943, PMCID 3049431, DOI 10.1038/embor.2010.206)
- « ExPASy SUMOplot »
- « Gene expression and genetic variation in response to endoplasmic reticulum stress in human cells », American Journal of Human Genetics, vol. 86, no 5, , p. 719–29 (PMID 20398888, PMCID 2869002, DOI 10.1016/j.ajhg.2010.03.017, lire en ligne)
- « NANOG-dependent function of TET1 and TET2 in establishment of pluripotency », Nature, vol. 495, no 7441, , p. 370–4 (PMID 23395962, PMCID 3606645, DOI 10.1038/nature11925, Bibcode 2013Natur.495..370C, lire en ligne)
- « Systematic and quantitative assessment of the ubiquitin-modified proteome », Molecular Cell, vol. 44, no 2, , p. 325–40 (PMID 21906983, PMCID 3200427, DOI 10.1016/j.molcel.2011.08.025)
- « Mass spectrometric analysis of lysine ubiquitylation reveals promiscuity at site level », Molecular & Cellular Proteomics, vol. 10, no 3, , M110.003590 (PMID 21139048, PMCID 3047152, DOI 10.1074/mcp.M110.003590, lire en ligne)
- « NCBI AceView db; QSER1 »
- « NCBI OMIM db; 11p13 »
- « NCBI OMIM db; Exudative Vitreoretinopathy 3 »
- « NCBI OMIM db; Candidiasis, Familial 3 »
- « NCBI OMIM db; Centralopathic Epilepsy »
- « NCBI OMIM db; Autosomal Recessive Deafness 51 »

