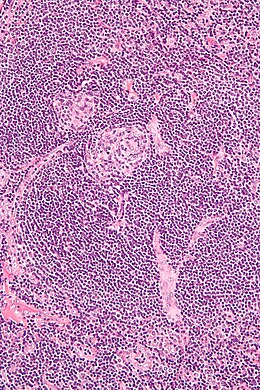
Maladie de Castleman
| Médicament | Siltuximab, rituximab et tocilizumab |
|---|---|
| Spécialité | Immunologie et angiologie |
| CIM-10 | D36.0 |
|---|---|
| CIM-9 | 785.6 |
| DiseasesDB | 2165 |
| MeSH | D005871 |
La maladie de Castleman (ou tumeur de Castleman, aussi dénommée hyperplasie géante ou angiofolliculaire ganglionnaire, hamartome lymphovasculaire, ou hyperplasie angio-folliculaire des ganglions lymphatiques) regroupe plusieurs troubles lymphoprolifératifs (plus de 5 000 nouveaux patients par an aux États-Unis) des ganglions lymphatiques, qui partagent certaines caractéristiques histologiques communes. L'une de ses trois grandes formes se développe souvent chez des patients infectés par le virus de l'herpès humain HHV8[1] et peut être associée à la maladie de Kaposi.
Cette maladie peut concerner un unique ganglion lymphatique (on parle alors de « maladie de Castleman unicentrique ») ou s'exprime chez plusieurs ganglions avec alors des effets plus systémiques et dangereux (on parle alors de « maladie de Castleman multicentrique ») :
- sous sa forme monocentrique, il s'agit d'une tumeur bénigne ganglionnaire de ganglion lymphatique qui siège toujours dans le médiastin[2], classiquement chez les sujets jeunes, avant la quatrième décennie, mais avec des exceptions. Son aspect à l'imagerie est celui d'une adénopathie unique ;
- sous sa forme multicentrique, la maladie de Castleman correspond à une hyperactivation du système immunitaire, ce qui se traduit notamment par la libération excessive de protéines pro-inflammatoires (cytokines), la prolifération de cellules immunitaires (cellules B et les cellules T) associée à de multiples dysfonctionnements d'organes[3].
La maladie de Castleman fait l'objet d'intenses recherches, et depuis peu, d'un processus de recherche collaborative impliquant des médecins, chercheurs et patients : le Castleman Disease Collaborative Network (CDCN)[1].
Histoire
[modifier | modifier le code]Le nom de cette maladie se réfère à Benjamin Castleman[1], le médecin de Boston qui fut le premier à décrire cette maladie, en 1954, à partir du cas d'un cadre de 40 ans qui souffrait de fièvres accompagnées d'une faiblesse inexpliquée, tout en présentant une masse inhabituelle dans la poitrine[1].
Les médecins ont d'abord soupçonné un cancer ou d'autres maladies mais, une fois la masse retirée chirurgicalement, elle s'est avérée être différente des tumeurs habituelles, présentant des caractéristiques qui la font depuis désigner comme maladie de Castleman unicentrique, ou localisée[1],[4]. D'autres formes de la maladie ont été ensuite décrites, classées comme suit.
Typologie
[modifier | modifier le code]Trois sous-types de la maladie sont souvent évoqués[5] :
- « Maladie de Castleman unicentrique », considérée comme moins grave et peut-être d'étiologie différente ;
- « Maladie de Castleman multicentrique associée au HHV-8 », variante grave de la maladie ;
- « Maladie de Castleman multicentrique non-associée au HHV-8 », dite idiopathique, autre forme grave de la maladie. Une forme de la maladie est surnommée « TAFRO » pour l'association thrombocytopénie, anasarque, fièvre, fibrose, insuffisance rénale et organomegalie[6].
Le syndrome POEMS est également un type de maladie de Castleman multicentrique[7].
La maladie
[modifier | modifier le code]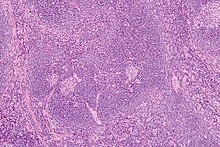
Elle doit être distinguée de troubles d'apparence identique (« Castleman-like » caractéristiques d'atteintes des ganglions lymphatiques, y compris l'hyperplasie réactive des ganglions lymphatiques, des troubles auto-immuns ou certaines tumeurs malignes[8].
Bien qu'officiellement non-considérée comme un cancer, cette prolifération de lymphocytes est assez similaire à un lymphome, et d'autres recherches sont nécessaires pour caractériser les petites populations de cellules néoplasiques[9].
Une hypothèse encore à l'étude est qu'il pourrait s'agir d'une sorte de « pré-lymphome » présentant aussi des caractéristiques auto-immunes, où des cellules dans les ganglions lymphatiques se mettent à proliférer et attaquer divers tissus[5].
Les médecins ont mis en évidence le rôle clé d'un messager du système immunitaire, l'interleukine-6 (IL-6) qui est, lors des phases d'expression de la maladie, sécrété en trop grande quantité par les ganglions lymphatiques, déclenchant une réaction inflammatoire massive et délétère soit localement, soit dans tout le corps si plusieurs zones ganglionnaires sont touchées. Mais on ne comprend pas encore l'origine de cette sécrétion anormale. D'une part un médicament supprimant la sécrétion d'IL-6 est dans certains cas inopérant[1], et d'autre part dans un certain nombre de cas la maladie semblerait pouvoir être reliée à un herpesvirus humain de type 8 (HHV-8), mais ce virus n'est pas retrouvé chez tous les patients (jamais dans les formes monocentriques et dans la moitié des cas des formes multicentriques)[5].
Les patients victimes de la forme multicentrique de la maladie ont aussi un risque accru de présenter une hémopathie maligne dans les 2 ans suivant le diagnostic de iMCD (Idiopathic Multicentric Castleman Disease). Les raisons de cette association sont encore mal comprises[5].
Une hypothèse en cours d'étude est que la prolifération cellulaire dans ces ganglions ne serait pas la cause première de la maladie, mais l'une de ses conséquences[1].
Prévalence
[modifier | modifier le code]Des estimations récentes suggèrent que les 3 sous-types de cette maladie sont moins rares qu'on ne l'a d'abord cru. Il y aurait environ 6 500 à 7 700 nouveaux cas par an rien qu'aux États-Unis et dans environ 1 cas sur 4, il s'agit de la forme multicentrique. Elle est par exemple plus fréquente aux États-Unis que la maladie de Charcot qui touche environ 5 600 nouvelles personnes chaque année[10].
La maladie peut survenir à tout âge (même chez de jeunes enfants) et toucher des hommes comme des femmes. La forme monocentrique apparaît plutôt chez les 20-30 ans et la forme multicentrique plus tardivement (plutôt chez les 40-60 ans)[5].
Symptômes
[modifier | modifier le code]Les signes cliniques et biologiques de la maladie sont peu spécifiques[5] :
- Symptômes pseudo-grippaux : fièvre, sueurs nocturnes, perte d'appétit, nausées et vomissements, faiblesse et fatigue
- Perte de poids involontaire
- Possibilité d'anémie inflammatoire, et d'hypergammaglobulinémie
- Un ou plusieurs ganglions lymphatiques augmentent de taille
- Hépatomégalie (hypertrophie du foie) ou Splénomégalie (hypertrophie de la rate)
- Défaillance d'un organe ou de plusieurs organes dans les formes multicentriques
- Neuropathie périphérique (engourdissement dans les mains et les pieds)
- Éruption des hémangiomes cerises (les proliférations bénignes des vaisseaux sanguins) sur la peau
- Œdème (gonflement), ascite (accumulation de liquide dans l'abdomen), et / ou d'autres symptômes de la surcharge liquidienne
- Diminution du débit urinaire avec toxicité systémique induite par l'insuffisance rénale
- Ecchymoses et saignement anormalement facile,
- Risque accru d'infection (causé par la défaillance de la moelle osseuse)
Les analyses biologiques de personnes atteintes présentent souvent des valeurs de laboratoire anormales pour les paramètres suivants :
- Vitesse de sédimentation (VS) élevée[5]
- Taux de protéine C-réactive (CRP) élevé (élément important du diagnostic)[5]
- Taux de fibrinogène élevé[5]
- taux d'hémoglobine faible (anémie) avec faible numération plaquettaire (thrombocytopénie)[5]
- Élévation de la créatinine et BUN, protéinurie[5]
- Taux d'albumine bas[5]
- Lymphocytes polyclonaux[5]
- Élévation de l'IL-6 et du VEGF[5]
- Anticorps auto-immuns, tels que les anticorps anti-nucléaire positif, les auto-anticorps anti-globules rouges et des anticorps anti-plaquettaires[5]
- Hypergammaglobulinémie[5]
Le diagnostic est compliqué dans les cas graves par les conséquences de divers organes. Il est confirmé (et par la même occasion le traitement définitif) par thoracotomie chirurgicale.
L'histologie (biopsie ostéomédullaire) montre des lésions qui peuvent orienter le diagnostic, associant une hyperplasie lymphatique et vasculaire, une plasmocytose, des atypies sur les mégacaryocytes, une fibrose. Ces constatations ne sont pas spécifiques[11].
La forme idiopathique est de diagnostic difficile et des critères ont été établis par un consensus international[12].
Pronostic
[modifier | modifier le code]À ce jour, malgré des progrès dans le traitement, c'est encore une maladie grave, fatale dans 35 % des cas[5]
Traitement
[modifier | modifier le code]La prise en charge de la forme idiopathique a fait l'objet de la publication de recommandations internationales datant de 2018[13]. La forme unicentrique bénéficie de recommandations publiées en 2020[14]. Les données histologiques ne permettent cependant pas d'orienter le traitement médicamenteux[15].
La forme unicentrique peut bénéficier d'une chirurgie, ou éventuellement d'une radiothérapie[16].
Le siltuximab, un anticorps monoclonal dirigé contre l'interleukine 6 permet d'améliorer les symptômes de la forme multicentrique[17]. Le rituximab et le cyclophosphamide permettent une réponse dans un patient sur deux[18]. les corticoïdes sont également utilisés[19].
Recherche et perspectives
[modifier | modifier le code]Un médecin lui-même victime de la maladie (qui a failli le tuer à 5 reprises) a abandonné son traitement classique (inhibiteur de l'interleukine 6) au profit d'un immunosuppresseur, traitement qui semble l'avoir protégé (depuis 2,5 ans mi-2016, délai qui n'est pas encore suffisant pour être considéré comme efficace, car des périodes de rémission existent chez les malades)[1].
La piste de facteurs génétiques est également explorée avec le séquençage du génome d'environ 10 patients atteint de la maladie de Castleman et de leurs parents, en comparant les éventuelles variations de niveaux de protéines exprimées lors des phases de poussées et des rémissions de la maladie.
Une stratégie de travail collaboratif a été mise en place par un groupe de médecins, patients et donateurs (« Castleman Disease Collaborative Network » ou CDCN) pour accélérer la recherche sur cette maladie, avec la volonté de traiter les questions prioritaires suivantes (liste 2016)[5] :
- Quelles sont les causes de l'activation du système immunitaire ? et de la production de cytokines dans les différentes formes de la maladie, tout particulièrement idiopathiques (UCD & IMCD) ? Parmi les hypothèses explorées figurent celle d'un virus ou un autre agent infectieux pouvant être en cause, celle d'une mutation génétique, celle d'un petit groupe de cellules cancéreuses qui pourraient sécréter des anticorps déclenchant une réaction du système immunitaire (mutation somatique). Une des autres hypothèses explorées est celle d'une production d'auto-anticorps (anticorps dirigés contre les tissus sains) car on en a détecté dans le sang d'au moins 20 % des patients IMCD.
- Quelles cellules immunitaires exactement sont responsables de la sécrétion de ces cytokines ? Quelles sont les voies cellulaires impliquées ? Ces questions sont notamment traitées par Vera Krymskaya (UPenn) qui va utiliser l'immunohistochimie et la cytométrie de flux pour déterminer quelles voies sont activés et quels types de cellules sont actives. Des expériences de culture cellulaire sont aussi prévues. Des analyses génétiques de ganglions congelés provenant de porteurs de la maladie sont également prévues.
- Quelles sont exactement toutes les cytokines libérées lors de la maladie (au-delà de l'IL-6) et avec quelles variations selon les stades de la maladie ? Les connaître permettrait de mieux comprendre la maladie, mais aussi de produire des tests de diagnostics.
- Quelles sont les thérapies existantes les plus efficaces pour interrompre la maladie ?
- Développer l'infrastructure de recherche ; pour lever l'un des freins à la recherche, un projet de biobanque d'échantillons est en cours. Il n'existe pas de critère de diagnostic internationalement reconnu, c'est aussi l'un des buts de l'association.
- Comment les médecins, les chercheurs et/ou les patients peuvent ensemble contribuer à renforcer la recherche au CDCN ?
- Les médecins conduisent la recherche clinique, aident à identifier et prioriser les projets de recherche axés sur les patients, et à regrouper des pannels de patients et collectent des échantillons biologiques nécessaires à la recherche. Ils permettent à des patients de fournir des données et des échantillons pour la recherche.
- Les chercheurs font de la recherche clinique, translationnelle et fondamentale pour aider à identifier et prioriser les projets de recherche à fort impact.
- Les patients aident à identifier et prioriser les projets de recherche axés sur les patients, ils contribuent à fournir des échantillons, informations et données d'intérêt pour la recherche sur leur maladie. Ils contribuent aussi à la mobilisation de fonds pour financer les études axées sur les patients.
En , le CDCN, l'UPenn, et une société pharmaceutique (encore anonyme) ont signé un accord pour mettre en place un « registre des patients » afin de mieux comprendre la maladie et l’efficacité relative de différents traitements.
Notes et références
[modifier | modifier le code]- Couzin-Frankel J. (2016) « A young doctor fights to cure his own rare, deadly disease », Science, 13 juillet 2016 ; DOI: 10.1126 / science.aaf5845.
- (en) Castleman B, Iverson L, Menendez VP, « Localized mediastinal lymphnode hyperplasia resembling lymphoma », Cancer, vol. 9, no 4, , p. 822-30. (PMID 13356266, DOI 10.1002/1097-0142(195607/08)9:4<822::aid-cncr2820090430>3.0.co;2-4)
- Fajgenbaum, David; van Rhee, Frits; Nabel, Chris (May 8, 2014). "HHV-8-negative, idiopathic multicentric Castleman disease: novel insights into biology, pathogenesis, and therapy". Blood 123 (19): 2924–33. doi:10.1182/blood-2013-12-545087 . .
- synd/3017 sur Who Named It?
- About Castleman Disease, CDCN, consulté 2016-07-17.
- Nishimura Y, Fajgenbaum DC, Pierson SK et al. Validated international definition of the thrombocytopenia, anasarca, fever, reticulin fibrosis, renal insufficiency, and organomegaly clinical subtype (TAFRO) of idiopathic multicentric Castleman disease, Am J Hematol, 2021;96:1241-1252
- Dispenzieri A, Fajgenbaum DC. Overview of Castleman disease, Blood, 2020;135:1353-1364
- Weng, Chien-Hsiang; Joe-Bin Chen; John Wang; Cheng-Chung Wu; Yuan Yu; Tseng-Hsi Lin (23 August 2011). "Surgically Curable Non-Iron Deficiency Microcytic Anemia: Castleman Disease". Onkologie 34 (8-9): 456–458. doi:10.1159/000331283 .
- "Castleman disease". Mayo Clinic. Consulté 2010-02-03.
- Site d'information sur l'ALS (voir Facts You Should Know).
- Belyaeva E, Rubenstein A, Pierson SK et al. Bone marrow findings of idiopathic Multicentric Castleman disease: a histopathologic analysis and systematic literature review, Hematol Oncol, 2022;40:191-201
- Fajgenbaum DC, Uldrick TS, Bagg A et al. International, evidence-based consensus diagnostic criteria for HHV-8-negative/idiopathic multicentric Castleman disease, Blood, 2017;129:1646-1657
- van Rhee F, Voorhees P, Dispenzieri A et al. International, evidence-based consensus treatment guidelines for idiopathic multicentric Castleman disease, Blood, 2018;132:2115-2124
- van Rhee F, Oksenhendler E, Srkalovic G et al. International evidence-based consensus diagnostic and treatment guidelines for unicentric Castleman disease, Blood Adv, 2020;4:6039-6050
- Fajgenbaum DC, Wu D, Goodman A et al. Insufficient evidence exists to use histopathologic subtype to guide treatment of idiopathic multicentric Castleman disease, Am J Hematol, 2020;95:1553-1561
- Beckham TH, Yang JC, Chau KW, Noy A, Yahalom J. Excellent outcomes with surgery or radiotherapy in the management of castleman disease including a case of oligocentric disease, Clin Lymphoma Myeloma Leuk, 2020;20:685-689
- van Rhee F, Wong RS, Munshi N et al. Siltuximab for multicentric Castleman’s disease: a randomised, double-blind, placebo-controlled trial, Lancet Oncol, 2014;15:966-974
- Dong Y, Zhang L, Nong L et al. Effectiveness of rituximab-containing treatment regimens in idiopathic multicentric Castleman disease, Ann Hematol, 2018;97:1641-1647
- Liu AY, Nabel CS, Finkelman BS et al. Idiopathic multicentric Castleman’s disease: a systematic literature review, Lancet Haematol, 2016;3:e163-e175