Chlorite de baryum
| Chlorite de baryum | |
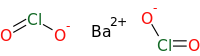
| |
| Identification | |
|---|---|
| Nom UICPA | chlorite de baryum |
| No CAS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | Ba(ClO2)2 |
| Masse molaire[1] | 272,231 ± 0,012 g/mol Ba 50,44 %, Cl 26,05 %, O 23,51 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorite de baryum est un composé inorganique ionique de formule brute Ba(ClO2)2. C'est le sel de baryum de l'acide chloreux.
Synthèse et propriété[modifier | modifier le code]
Le chlorite de baryum est synthétisé à partir d'hydroxyde de baryum et de dioxyde de chlore dans l'eau en présence de peroxyde d'hydrogène :
- 2 ClO2 + Ba(OH)2.8H2O + H2O2 → Ba(ClO2)2 + O2 + 10 H2O
Le chlorite de baryum hydraté, Ba(ClO2)2.3,5H2O cristallise dans le système cristallin monoclinique, groupe d'espace C2/c (n° 15). La maille élémentaire contient 8 unités Ba(ClO2)2.3,5H2O[2].
Utilisation[modifier | modifier le code]
Le chlorite de baryum peut être employé pour générer des solutions d'acide chloreux ou d'autres sels de cet acide par ajout en solution d'acide sulfurique ou de sulfates correspondants. Le sulfate de baryum est insoluble, il précipite et laisse en solution les anions chlorites et les protons de l'acide sulfurique ou les cations des sulfates.
Sécurité[modifier | modifier le code]
Chauffé, le chlorite de baryum peut exploser[3].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Anton I. Smolentsev, Dmitry Yu. Naumov, Barium chlorite hydrate, Ba(ClO2)2.3.5H2O, Acta Cryst., 2005, vol. 61(5), pp. 49-59. résumé.
- Réactions chimiques dangereuses[PDF].
