Néoplasie cervicale intra-épithéliale
| Spécialité | Oncologie |
|---|
| CIM-10 | D06 et N87 |
|---|---|
| CIM-9 | 233.1 et 622.10 |
| MedlinePlus | 001491 |
La néoplasie cervicale intra-épithéliale (NCI), également connue sous le nom de dysplasie cervicale, est la croissance anormale de cellules à la surface du col de l'utérus qui pourrait potentiellement conduire au cancer du col de l'utérus[1]. Plus spécifiquement, NCI fait référence à la transformation potentiellement précancéreuse des cellules du col de l'utérus.
La néoplasie cervicale intra-épithéliale se produit le plus souvent à la jonction pavimento-cylindrique du col de l'utérus, une zone de transition entre l'épithélium pavimenteux du vagin et l'épithélium cylindrique de l'endocol[2]. Elle peut également survenir sur les parois vaginales et l'épithélium vulvaire. La NCI est notée sur une échelle de 1 à 3, 3 étant le plus anormal (voir la section de classification ci-dessous).
L'infection par le virus du papillome humain (VPH) est nécessaire pour le développement de la NCI, mais toutes les personnes atteintes de cette infection ne développent pas un cancer du col de l'utérus[3]. De nombreuses femmes infectées par le (VPH) ne développent jamais de (NCI) ou de cancer du col de l'utérus. En règle générale, le (VPH) se résout tout seul[4]. Cependant, ceux qui ont une infection au (VPH) qui dure plus d'un ou deux ans ont un risque plus élevé de développer un (NCI) de grade supérieur[5].
Comme les autres néoplasies intraépithéliales, la (NCI) n'est pas un cancer et est généralement guérissable[3]. La plupart des cas de (NCI) restent stables ou sont éliminés par le système immunitaire de la personne sans intervention. Cependant, s'ils ne sont pas traités, un petit pourcentage de cas évolue vers un cancer du col de l'utérus, généralement un carcinome épidermoïde cervical (CSC)[6].
Signes et symptômes[modifier | modifier le code]
Il n'y a pas de symptômes spécifiques de la NCI seule.
En général, les signes et symptômes du cancer du col utérin sont[7] :
- saignements anormaux ou post-ménopausiques ;
- décharge anormale ;
- modifications de la fonction vésicale ou intestinale ;
- douleur pelvienne à l'examen ;
- apparence anormale ou palpation du col de l'utérus.
L'infection par le VPH de la vulve et du vagin peut provoquer des verrues génitales ou être asymptomatique.
Causes[modifier | modifier le code]
L'origine de la NCI est une infection chronique du col de l'utérus par le VPH, en particulier une infection par les types de VPH à haut risque 16 ou 18. On pense que les infections à HPV à haut risque ont la capacité d'inactiver les gènes suppresseurs de tumeurs tels que le gène p53 et le gène RB, permettant ainsi aux cellules infectées de se développer sans contrôle et d'accumuler des mutations successives, conduisant finalement au cancer[1].
Certains groupes de femmes présentent un risque plus élevé de développer une NCI[1],[8] :
- infection par un type de VPH à haut risque, tel que 16, 18, 31 ou 33 ;
- immunodéficience (par exemple infection par le VIH) ;
- mauvaise alimentation ;
- partenaires sexuels multiples ;
- manque d'utilisation du préservatif ;
- tabagisme.
De plus, il a été démontré qu'un certain nombre de facteurs de risque augmentent la probabilité d'un individu de développer un NCI de grade 3/un carcinome in situ (voir ci-dessous)[9] :
- femmes qui accouchent avant 17 ans ;
- femmes qui ont plus d'une grossesse à terme.
Physiopathologie[modifier | modifier le code]

Le premier changement microscopique correspondant à la NCI est la dysplasie épithéliale, ou revêtement de surface, du col de l'utérus, qui est essentiellement indétectable par la femme. La majorité de ces changements se produisent au niveau de la jonction pavimento-cylindrique, ou zone de transformation, une zone d'épithélium cervical instable qui est sujette à des changements anormaux[2]. Les changements cellulaires associés à l'infection par le VPH, tels que les koilocytes, sont également fréquemment observés dans les NCI. Bien que l'infection par le VPH soit nécessaire au développement de la NCI, la plupart des femmes infectées par le VPH ne développent pas de lésions intra-épithéliales de haut grade ou de cancer. Le VPH n'est pas à lui seul suffisamment causal[10].
Parmi les plus de cent types différents de VPH, environ quarante sont connus pour affecter le tissu épithélial de la région anogénitale et ont différentes probabilités de provoquer des changements malins[11].
Diagnostic[modifier | modifier le code]
Un test pour le HPV appelé le « test Digene HPV » est très précis et sert à la fois de diagnostic direct et d'adjuvant au frottis cervical. Une colposcopie avec biopsie dirigée est la norme pour la détection des maladies. Un prélèvement à la brosse endocervicale au moment du frottis cervical pour détecter l'adénocarcinome et ses précurseurs est nécessaire, ainsi que la vigilance du médecin/patient sur les symptômes abdominaux associés au carcinome utérin et ovarien. Le diagnostic de NCI ou de carcinome cervical nécessite une biopsie pour analyse histologique.[réf. nécessaire]
Classification[modifier | modifier le code]

Historiquement, les modifications anormales des cellules épithéliales cervicales étaient décrites comme une dysplasie épithéliale légère, modérée ou sévère. En 1988, l'Institut national du cancer a développé le « Système Bethesda pour la notification des diagnostics cytologiques cervicaux/vaginaux »[12]. Ce système fournit une manière uniforme de décrire les cellules épithéliales anormales et de déterminer la qualité des échantillons, fournissant ainsi des conseils clairs pour la gestion clinique. Ces anomalies ont été classées comme squameuses ou glandulaires, puis classées en fonction du stade de la dysplasie : cellules atypiques, légères, modérées, sévères et carcinomes[13].
En fonction de plusieurs facteurs et de l'emplacement de la lésion, la NCI peut débuter à partir de n'importe laquelle des trois stades et peut ensuite progresser ou régresser[1]. Le grade de la lésion intraépithéliale squameuse peut varier.
La NCI est classée en grades[14] :
| Grade histologique | Cytologie correspondante | Description | Image |
|---|---|---|---|
| 1 (catégorie I) | Lésion malpighienne intra-épithéliale de bas grade (LSIL) |
|
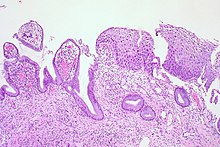
|
| 2/3 | Lésion malpighienne intra-épithéliale de haut grade (HSIL). |
|
|
| 2 (grade II) |
|
 | |
| 3 (grade III) |
|
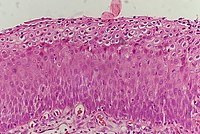 |


En 2012, un changement de terminologie décrivant les lésions squameuses associées au VPH a été approuvé par le College of American Pathology et l'American Society of Colposcopy and Cervical Pathology. Les changements sont les suivants[16] :
- la NCI 1 est appelée « LSIL » ;
- la NCI 2 qui est négative pour p16, un marqueur du VPH à haut risque, est appelée « LSIL ». Celles qui sont p16-positives sont appelées « HSIL » ;
- la NCI 3 est appelée « HSIL ».
Dépistage[modifier | modifier le code]
Les deux méthodes de dépistage disponibles sont le frottis cervical et le dépistage du VPH. La NCI est généralement découverte par un frottis. Le but de ce test est de détecter des changements potentiellement précancéreux grâce à un échantillonnage aléatoire de la zone de transformation. Les résultats du frottis peuvent être rapportés à l'aide du système Bethesda (voir ci-dessus). La sensibilité et la spécificité de ce test étaient variables dans une revue systématique portant sur l'exactitude du test. Un test de frottis anormal peut conduire à une recommandation de colposcopie du col de l'utérus, une procédure en cabinet au cours de laquelle le col de l'utérus est examiné sous grossissement à l'aide d'un microscope. Chaque zone d'apparence anormale fait l'objet d'un prélèvement/biopsie.[réf. nécessaire]
La colposcopie peut parfois être douloureuse chez certaines patientes. Certaines études suggèrent que l'injection d'un anesthésique local et d'un vasoconstricteur dans le col de l'utérus peut réduire la perte de sang et la douleur pendant la colposcopie[17].
Les tests HPV peuvent identifier la plupart des types de HPV à haut risque responsables de la NCI. Le dépistage du VPH s'effectue soit lors du frottis, soit après un frottis montrant des cellules anormales. L'Organisation mondiale de la santé a également des directives de dépistage et de traitement des lésions précancéreuses du col utérin et de prévention du cancer du col utérin.[réf. nécessaire]
Prévention primaire[modifier | modifier le code]
La vaccination contre le VPH est l'approche principale de prévention primaire à la fois des NCI et du cancer du col de l'utérus.
| Vaccin | Génotypes de HPV protégés contre | Qui l'obtient ? | Nombre de doses | Recommandation de timing |
|---|---|---|---|---|
| Gardasil - quadrivalent | 6, 11 (causent des verrues génitales) 16, 18 (causent la plupart des cancers du col de l'utérus) | Femmes et hommes de 9 à 26 ans | 3 | Avant tout début de rapports sexuels ou peu de temps après. |
| Cervarix - bivalent | 16, 18 | Femmes de 9 à 25 ans | 3 | |
| Gardasil 9 - vaccin nonavalent | 6, 11, 16, 18, 31, 33, 45, 52, 58 (≈15 % de cancer du col de l'utérus) | Femmes et hommes âgés de 9 à 26 ans | 3 |
Il est important de noter que ces vaccins ne protègent pas contre 100 % des types de VPH connus pour causer le cancer. Par conséquent, le dépistage est toujours recommandé chez les personnes vaccinées.
Prévention secondaire[modifier | modifier le code]
Une gestion appropriée avec surveillance et traitement constitue la prévention secondaire du cancer du col utérin chez les personnes atteintes de CIN.
Traitement[modifier | modifier le code]
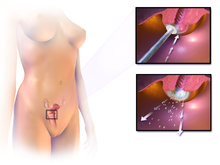
Le traitement de la NCI 1, dysplasie légère, n'est pas recommandé si la lésion dure depuis moins de deux ans. Habituellement, lorsqu'une biopsie détecte la NCI 1, la patiente a une infection au VPH, qui peut disparaître d'elle-même dans les douze mois qui suivent. Par conséquent, la NCI est plutôt suivie avec des tests planifiés ultérieurement plutôt que traitée. Chez les jeunes femmes, une surveillance étroite des lésions NCI 2 semble également raisonnable[6].
Le traitement de la NCI de haut grade implique l'élimination ou la destruction des cellules cervicales anormales par cryocautérisation, électrocautérisation, cautérisation au laser, procédure d'excision électrique de l'anse (LEEP) ou conisation cervicale. Le seuil typique de traitement est NCI 2+, bien qu'une approche plus restreinte puisse être adoptée pour les jeunes et les femmes enceintes. Une revue Cochrane n'a pu désigner quelle technique chirurgicale était la meilleure pour le traitement de la NCI[18]. Les preuves suggèrent que si les rétinoïdes ne sont pas efficaces pour prévenir la progression de la NCI, ils peuvent être efficaces pour provoquer une régression de la maladie chez les femmes atteintes de NCI 2[19]. Les vaccins thérapeutiques font actuellement l'objet d'essais cliniques. Le taux de récidive à vie de NCI est d'environ 20 %,[réf. nécessaire] mais il n'est pas aisé de conclure quelle proportion de ces cas sont de nouvelles infections plutôt que des récidives de l'infection originale.
Les recherches visant à déterminer si les antibiotiques prophylactiques peuvent aider à prévenir l'infection chez les femmes subissant une excision de la zone de transformation cervicale ont révélé un manque de preuves fiables[20].
Le traitement chirurgical des lésions NCI est associé à un risque accru d'infertilité ou d'hypofertilité. Une étude cas-témoins a révélé qu'il y avait une augmentation d'environ deux fois du risque[21].
Les résultats d'études observationnelles de faible qualité suggèrent que les femmes recevant un traitement contre la NCI pendant la grossesse peuvent présenter un risque accru de naissance prématurée[22],[23]. Les personnes vivant avec le VIH et NCI 2+ devraient être initialement gérées selon les recommandations pour la population générale selon les lignes directrices consensuelles de l'ASCCP mises à jour en 2012[24].
Évolutions[modifier | modifier le code]
On pensait autrefois que les cas de NCI progressaient des stades 1 à 3 jusqu'au cancer de manière linéaire[25],[26],[27].
En fait, la plupart des NCI régressent spontanément. Sans traitement, environ 70 % de NCI 1 régresseront en un an ; 90 % régresseront d'ici deux ans[28]. Environ 50 % des cas de NCI 2 régresseront dans les deux ans sans traitement.
L'évolution vers un carcinome cervical in situ (CIS) survient dans environ 11 % des cas de NCI 1 et 22 % des cas de NCI 2. La progression vers un cancer invasif survient dans environ 1 % des cas de NCI 1, 5 % des NCI 2 et au moins 12 % des cas de NCI 3[3].
La progression vers le cancer prend généralement quinze ans avec une plage de trois à quarante ans. Cependant, des preuves suggèrent que le cancer peut survenir sans avoir d'abord progressé de manière détectable à travers les stades de NCI et qu'une néoplasie intraépithéliale de haut grade peut survenir sans d'abord exister en tant que grade inférieur[1],[25],[29].
La recherche suggère que le traitement n'affecte pas les chances de tomber enceinte, mais il est associé à un risque accru de fausse couche au cours du deuxième trimestre[30].
Épidémiologie[modifier | modifier le code]
Entre 250 000 et 1 million de femmes américaines reçoivent un diagnostic de NCI chaque année. Les femmes peuvent développer une NCI à tout âge, mais cela arrive généralement entre 25 et 35 ans[1]. L'incidence annuelle estimée des NCI aux États-Unis chez les personnes qui subissent un dépistage est de 4 % pour les NCI 1 et de 5 % pour les NCI 2 et NCI 3[31].
Références[modifier | modifier le code]
- Vinay Kumar, Abul K. Abbas, Nelson Fausto et Richard N. Mitchell, Robbins Basic Pathology, 8th, , 718–721 p. (ISBN 978-1-4160-2973-1).
- « Colposcopy and treatment of cervical intraepithelial neoplasia: a beginners manual », screening.iarc.fr (consulté le ).
- Section 4 Gynecologic Oncology > Chapter 29. Preinvasive Lesions of the Lower Genital Tract > Cervical Intraepithelial Neoplasia in:Karen D. Bradshaw, John O. Schorge, Joseph Schaffer, Lisa M. Halvorson et Hoffman, Williams' Gynecology, McGraw-Hill Professional, (ISBN 978-0-07-147257-9).
- (en) « Human papillomavirus (HPV) and cervical cancer », who.int (consulté le ).
- « Human papilloma virus: Apprehending the link with carcinogenesis and unveiling new research avenues (Review) », International Journal of Oncology, vol. 52, no 3, , p. 637–655 (PMID 29393378, PMCID 5807043, DOI 10.3892/ijo.2018.4256).
- « Clinical course of untreated cervical intraepithelial neoplasia grade 2 under active surveillance: systematic review and meta-analysis », BMJ, vol. 360, , k499 (PMID 29487049, PMCID 5826010, DOI 10.1136/bmj.k499).
- Clinical Gynecologic Oncology, Philadelphia, Mosby Elsevier, , 55 p., « Invasive cervical cancer ».
- « Prevention of cervical cancer in women with HIV », Current Opinion in HIV and AIDS, vol. 4, no 1, , p. 68–73 (PMID 19339941, DOI 10.1097/COH.0b013e328319bcbe).
- International Collaboration of Epidemiological Studies of Cervical Cancer, « Cervical carcinoma and reproductive factors: collaborative reanalysis of individual data on 16,563 women with cervical carcinoma and 33,542 women without cervical carcinoma from 25 epidemiological studies », International Journal of Cancer, vol. 119, no 5, , p. 1108–1124 (ISSN 0020-7136, PMID 16570271, DOI 10.1002/ijc.21953).
- « Human papillomavirus and human disease », The American Journal of Medicine, vol. 102, no 5A, , p. 9–15 (PMID 9217657, DOI 10.1016/s0002-9343(97)00178-2).
- « Classification of papillomaviruses », Virology, vol. 324, no 1, , p. 17–27 (PMID 15183049, DOI 10.1016/j.virol.2004.03.033).
- « The 1988 Bethesda System for reporting cervical/vaginal cytologic diagnoses: developed and approved at the National Cancer Institute workshop in Bethesda, MD, December 12-13, 1988 », Diagnostic Cytopathology, vol. 5, no 3, , p. 331–4 (PMID 2791840, DOI 10.1002/dc.2840050318).
- « The 2001 Bethesda System: terminology for reporting results of cervical cytology », JAMA, vol. 287, no 16, , p. 2114–9 (PMID 11966386, DOI 10.1001/jama.287.16.2114).
- « Natural history of cervical squamous intraepithelial lesions: a meta-analysis », Obstetrics and Gynecology, vol. 92, no 4 Pt 2, , p. 727–35 (PMID 9764690, DOI 10.1097/00006250-199810001-00046).
- « Endocervical glandular involvement is associated with high-grade SIL », Gynecologic Oncology, vol. 102, no 2, , p. 240–3 (PMID 16472847, DOI 10.1016/j.ygyno.2005.12.029).
- « The Lower Anogenital Squamous Terminology Standardization project for HPV-associated lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology », International Journal of Gynecological Pathology, vol. 32, no 1, , p. 76–115 (PMID 23202792, DOI 10.1097/PGP.0b013e31826916c7).
- « Pain relief for women with cervical intraepithelial neoplasia undergoing colposcopy treatment », The Cochrane Database of Systematic Reviews, vol. 7, , p. CD006120 (PMID 27428114, PMCID 6457789, DOI 10.1002/14651858.cd006120.pub4).
- Pierre P.L. Martin-Hirsch, Evangelos Paraskevaidis, Andrew Bryant et Heather O. Dickinson, « Surgery for cervical intraepithelial neoplasia », Cochrane Database of Systematic Reviews, no 12, , p. CD001318 (ISSN 1465-1858, PMID 24302546, PMCID 4170911, DOI 10.1002/14651858.cd001318.pub3).
- C. William Helm, Douglas J. Lorenz, Nicholas J. Meyer et William W.R. Rising, « Retinoids for preventing the progression of cervical intra-epithelial neoplasia », Cochrane Database of Systematic Reviews, no 6, , p. CD003296 (ISSN 1465-1858, PMID 23740788, DOI 10.1002/14651858.cd003296.pub3).
- « Antibiotics for infection prevention after excision of the cervical transformation zone », The Cochrane Database of Systematic Reviews, vol. 1, , p. CD009957 (PMID 28109160, PMCID 6464760, DOI 10.1002/14651858.cd009957.pub2).
- « Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions: systematic review and meta-analysis », Lancet, vol. 367, no 9509, , p. 489–98 (PMID 16473126, DOI 10.1016/S0140-6736(06)68181-6).
- « Adverse obstetric outcomes after local treatment for cervical preinvasive and early invasive disease according to cone depth: systematic review and meta-analysis », BMJ, vol. 354, , i3633 (PMID 27469988, PMCID 4964801, DOI 10.1136/bmj.i3633).
- « Obstetric outcomes after conservative treatment for cervical intraepithelial lesions and early invasive disease », The Cochrane Database of Systematic Reviews, vol. 11, , p. CD012847 (PMID 29095502, PMCID 6486192, DOI 10.1002/14651858.cd012847).
- « 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors », Journal of Lower Genital Tract Disease, vol. 17, no 5 Suppl 1, , S1–S27 (PMID 23519301, DOI 10.1097/LGT.0b013e318287d329).
- « Detection and typing of human papillomavirus DNA in uterine cervices with coexistent grade I and grade III intraepithelial neoplasia: biologic progression or independent lesions? », European Journal of Obstetrics, Gynecology, and Reproductive Biology, vol. 121, no 1, , p. 99–103 (PMID 15949888, DOI 10.1016/j.ejogrb.2004.11.024).
- « Evaluation of different treatment modalities for vulvar intraepithelial neoplasia (VIN): CO(2) laser vaporization, photodynamic therapy, excision and vulvectomy », Gynecologic Oncology, vol. 100, no 2, , p. 271–5 (PMID 16169064, DOI 10.1016/j.ygyno.2005.08.012).
- « The papillomavirus E6 proteins », Biochimica et Biophysica Acta (BBA) - Reviews on Cancer, vol. 1378, no 1, , F1-19 (PMID 9739758, DOI 10.1016/s0304-419x(98)00009-2).
- « Epidemiology and natural history of human papillomavirus infections and type-specific implications in cervical neoplasia », Vaccine, vol. 26 Suppl 10, no Supplement 10, , K1-16 (PMID 18847553, DOI 10.1016/j.vaccine.2008.05.064).
- « Dynamics of HPV16 DNA load reflect the natural history of cervical HPV-associated lesions », Journal of Clinical Virology, vol. 35, no 3, , p. 270–7 (PMID 16214397, DOI 10.1016/j.jcv.2005.09.001).
- « Fertility and early pregnancy outcomes after conservative treatment for cervical intraepithelial neoplasia », The Cochrane Database of Systematic Reviews, no 9, , p. CD008478 (PMID 26417855, PMCID 6457639, DOI 10.1002/14651858.CD008478.pub2).
- « Diagnoses and outcomes in cervical cancer screening: a population-based study », American Journal of Obstetrics and Gynecology, vol. 191, no 1, , p. 105–13 (PMID 15295350, DOI 10.1016/j.ajog.2004.01.043).

