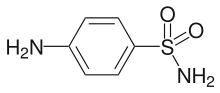
Sulfanilamide
| Sulfanilamide | |
| |
| Identification | |
|---|---|
| Nom UICPA | 4-aminobenzènesulfonamide |
| Synonymes |
Sulfamide, sulfonamide, 1662 F, |
| No CAS | |
| No ECHA | 100.000.513 |
| No CE | 200-563-4 |
| Code ATC | J01 D06 |
| DrugBank | DB00259 |
| PubChem | 5333 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline blanche |
| Propriétés chimiques | |
| Formule | C6H8N2O2S [Isomères] |
| Masse molaire[2] | 172,205 ± 0,011 g/mol C 41,85 %, H 4,68 %, N 16,27 %, O 18,58 %, S 18,62 %, |
| pKa | 10,58 à 20 °C[réf. souhaitée] |
| Propriétés physiques | |
| T° fusion | 165,5 °C[réf. souhaitée] |
| Solubilité | 7,5 g L−1 eau à 25 °C[réf. souhaitée] Peu soluble dans l'alcool. Soluble dans les graisses. Insoluble dans le benzène, l'éther, le chloroforme |
| Masse volumique | 1,08 g cm−3[réf. souhaitée] |
| Écotoxicologie | |
| DL50 | 3 000 mg kg−1 souris oral 500 mg kg−1 souris i.v. 2 900 mg kg−1 souris s.c. 5 mg kg−1 souris i.p.[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sulfanilamide, de formule brute C6H8N2O2S, soluble dans l'éthylène glycol, est le membre le plus simple d'une famille de médicaments : les sulfanilamides. Il inhibe une enzyme nécessaire à la production d'acide folique par les bactéries et est donc un médicament antibactérien.
Les sulfanilamides sont des molécules contenant le groupe fonctionnel sulfonamide lié à l'aniline.
Mode d'action[modifier | modifier le code]

Le sulfanilamide et ses dérivés sont des analogues structuraux de l'acide p-aminobenzoïque ou PABA. Ce dernier composé est l'un des éléments qui interviennent dans la synthèse des folates chez les bactéries et les plantes. Le sulfanilamide est un inhibiteur de la dihydroptéroate synthase, l'enzyme qui catalyse la condensation du 6-hydroxyméthyl-7,8-dihydroptéridine pyrophosphate à l'acide para-aminobenzoïque pour former le 7,8-dihydroptéroate. Le sulfanilamide est utilisé par la dihydroptéroate synthase comme substrat à la place du PABA. Cette « fausse réaction » avec le sulfanilamide conduit à la formation d'un produit inactif, qui ne peut subir l'étape métabolique suivante pour donner le dihydrofolate, réaction qui est catalysée par la dihydrofolate synthase.
Le dihydrofolate étant un cofacteur essentiel à de nombreuses voies métaboliques (synthèse des nucléotides, de certains acides aminés, réaction de méthylation), les bactéries ne peuvent se développer.
Chez les animaux, les folates ne sont pas synthétisés par l'organisme, mais sont obtenus par l'alimentation (vitamine B9) et il n'y a donc pas d'action inhibitrice du sulfanilamide et de ses dérivés.
Histoire[modifier | modifier le code]
Le sulfanilamide est synthétisé dès 1908, à Vienne, par Paul Gelmo[3], assistant de Wilhelm Suida[4]. Mais l'inventeur ne remarque pas les propriétés thérapeutiques de son produit et il faut attendre plus d'un quart de siècle pour que, étudiant l'activité antibactérienne du Prontosil (sulfamidochrysoïdine) mis au point par Domagk en 1935[5], Jacques et Thérèse Tréfouël, Daniel Bovet et Federico Nitti, dans le laboratoire d'Ernest Fourneau à l'Institut Pasteur, isolent le sulfanilamide, métabolite du médicament de Domagk. Dès la fin de la même année 1935, ils démontrent que ce para-aminophénylsulfamide, ou 1162 F, est l'agent thérapeutique incolore de la sulfamidochrysoïdine colorante[6]. Renversant l'axe des recherches, jusqu'alors poursuivies dans l'idée que l'action antibactérienne des colorants azoïques était attachée à leurs propriétés tinctoriales, ils ouvrent ainsi la voie à la sulfamidothérapie[4].
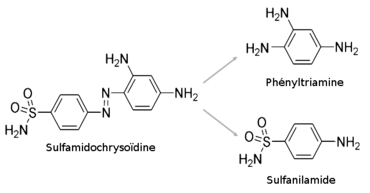
Connu de longue date, le sulfanilamide ne peut être breveté, et non seulement sa formule va servir de base à la synthèse des autres médicaments sulfamidés, mais elle sera commercialisée à l’identique sous un nombre considérable de marques, à commencer par le Prontosil album, lancé dès 1936 par IG Farben[7], et par le Septoplix, vendu à partir de 1937 par les laboratoires Théraplix, issus de la fusion de la société du Radium médical et des établissements Albert-Buisson[8].
Le désastre de l'élixir de sulfanilamide[modifier | modifier le code]
En 1937, pour répondre à une demande d'un client souhaitant utiliser le sulfanilamide sous forme liquide, Samuel Evans Messengill Co, un fabricant de Bristol, dans le Tennessee, a solubilisé la molécule dans l'éthylène glycol. L'odeur, le goût et l'aspect ayant été jugés satisfaisants, 633 commandes ont été expédiées aux quatre coins des États-Unis, sous le nom d'« elixir of sulfanilamide ». Plus de cent patients en sont morts, l'éthylène glycol causant une insuffisance rénale aiguë[9].
C'est seulement après cet accident que la Food and Drug Administration (FDA) a exigé que des études de toxicité soient menées préalablement à la mise sur le marché d'un nouveau médicament.
Seconde Guerre mondiale[modifier | modifier le code]
Dans l'équipement des soldats américains existait une boîte appelée « First Aid, Packet, US Government Carlisle Model ». Elle contenait un pansement. Mais à partir de 1941, un petit sachet en papier contenant des cristaux de sulfanilamide y a été ajouté. La procédure était de verser le contenu du sachet sur la plaie puis de la couvrir avec le pansement.
Bibliographie[modifier | modifier le code]
- Daniel Bovet, Une chimie qui guérit : Histoire de la découverte des sulfamides, Paris, Payot, coll. « Médecine et sociétés » (no 13), , 322 p. (ISBN 2-228-88108-2 et 978-2-228-88108-1, BNF 35007298).
Liens externes[modifier | modifier le code]
- Spectre de masse, spectre UV et visible, sur webbook.nist.gov
Notes et références[modifier | modifier le code]
- PubChem 5333.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- P. Gelmo, « Uber sulfamide der p.aminobenzolsulfonsäure », Journal für praktische Chemie, vol. 77, 1908, p. 369.
- Bovet 1988, p. 48.
- G. Domagk, « Ein Beitrag zur Chemotherapie der bakteriellen Infektionen », dans Deutsch. Med. Wschr., vol. 61, 15 février 1935, p. 250.
- Jacques Tréfouël, Thérèse Tréfouël, Federico Nitti et Daniel Bovet, « Activité du p-aminophénylsulfamide sur l’infection streptococcique expérimentale de la souris et du lapin », Comptes rendus de la Société de biologie, vol. 120, , p. 756.
- G. Domagk, « Chemotherapie der Streptokokkeninfektionen », dans Klin. Wschr., vol. 15, 31 octobre 1936, p. 1585.
- Association corporative des étudiants en pharmacie, université de Rennes 1.
- (en) Carol Ballentine, Sulfanilamide Disaster [PDF], FDA Consumer magazine, juin 1981.
