Thrombose veineuse profonde
| Spécialité | Cardiologie |
|---|
| CIM-10 | I80 |
|---|---|
| CIM-9 | 451 |
| DiseasesDB | 13043 |
| MedlinePlus | 000156 |
| eMedicine |
1911303 emerg/582med/3201 |
| MeSH | D010689 |
| Patient UK | Deep-vein-thrombosis-pro |
La thrombose veineuse profonde (TVP), phlébite profonde[1] ou thrombophlébite est, avec l’embolie pulmonaire, une des deux manifestations de la maladie thromboembolique. Elle est due à la formation d’un caillot (thrombus) dans le réseau veineux profond des membres inférieurs (thrombose veineuse). Il existe également, mais très rarement, des thrombophlébites cérébrales (AVC).
Si le caillot se détache et migre dans une artère pulmonaire, cela constitue une embolie pulmonaire.
On parle de thrombose veineuse superficielle (ou abusivement de paraphlébite) pour décrire une phlébite très superficielle d’une petite veine.
Anatomie des veines des membres inférieurs
[modifier | modifier le code]Le réseau veineux est formé de deux entités distinctes entre lesquelles existent des communications :
- le réseau veineux superficiel est situé sous la peau, au-dessus des muscles (sus-aponévrotique). Sa fonction est le drainage de la peau et des tissus situés sous cette dernière (dits sous-cutanés). Il est souvent directement visible. L’augmentation anormale du calibre des veines de ce réseau forme les varices ;
- le réseau veineux profond draine les muscles et les tissus profonds. Il est dit sous-aponévrotique car situé derrière la membrane fibreuse séparant les muscles de la peau (aponévrose).
Les communications entre ces deux réseaux se font par des veines dites perforantes qui, en conditions normales, ne permettent des échanges que dans le sens réseau superficiel vers réseau profond.
Les veines sont munies en dessous du pli de l’aine (correspondant anatomiquement au ligament inguinal) de valvules empêchant le reflux sanguin et les échanges dans le sens réseau veineux profond vers réseau veineux superficiel et dans le sens proximal vers la distalité. Ces valvules ont une densité décroissante à mesure que l’on se rapproche de la racine des membres. Elles sont également plus nombreuses au niveau du système profond. Elles imposent donc la circulation du système superficiel vers le système profond et du bas vers le haut (pour un sujet debout).
En cas d’altération des valves, destruction, absence (agénésie) ou inefficacité par dilatation de la veine, on obtient un tableau d’incontinence veineuse dont la manifestation la plus visible est la formation de varices.
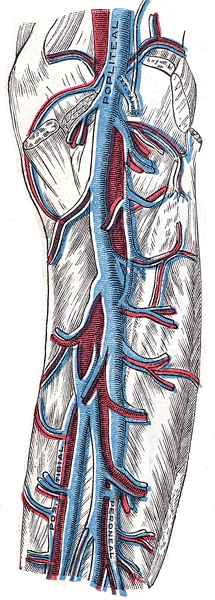
Réseau veineux profond
[modifier | modifier le code]Il est constitué par les veines satellites des artères aux membres inférieurs. Ces veines prennent le nom de l’artère correspondante. Elles sont, en règle générale, au nombre de deux par artère en dessous du genou et uniques au-dessus. Elles sont le plus souvent très proches des os.
- Au niveau de la jambe (niveau sural) :
- veines tibiales antérieures dans la partie antéro-externe du mollet ;
- veines tibiales postérieures dans la partie postérieure du mollet ;
- veines fibulaires dans la loge(partie) postérieure ;
- veines musculaires, comprenant les veines jumelles et soléaires, situées respectivement au sein des muscles jumeaux et soléaire (dont l’ensemble forme le triceps sural).
La réunion des veines tibiales postérieures et fibulaires forme le tronc tibio-fibulaire qui s’unit aux veines tibiales antérieures pour donner naissance à la veine poplitée qui peut être dédoublée dans un tiers des cas. Les veines jumelles se jettent dans la veine poplitée au niveau du creux du même nom (arrière du genou).
- Au niveau de la cuisse :
- la veine fémorale superficielle, principale veine collectrice, pouvant être dédoublée ;
- la veine fémorale profonde, veine collectrice accessoire ;
- la veine fémorale commune issue de la réunion de la fémorale superficielle et de la profonde au niveau du ligament inguinal, situé au pli de l’aine. Elle reçoit la veine saphène interne, un peu au-dessus, au niveau du trigone fémoral. Son trajet est parallèle à celui de l’artère fémorale et situé en dedans de cette dernière.
- Au-dessus du pli de l’aine :
- La veine fémorale commune devient veine iliaque externe puis veine iliaque primitive à la suite de sa réunion avec la veine iliaque interne. La réunion des deux veines iliaques primitives au niveau de la cinquième vertèbre lombaire donnant naissance à la veine cave inférieure.
Réseau veineux superficiel
[modifier | modifier le code]Les deux veines principales de ce réseau sont les veines saphène interne (ou grande saphène) et saphène externe (ou petite saphène).
- La veine saphène interne naît en regard de la malléole interne (excroissance osseuse de la partie inférieure et interne du tibia au-dessus de la cheville) et chemine plus ou moins verticalement le long de la face interne du membre inférieur. Au niveau du trigone fémoral, elle traverse une aponévrose, le fascia cribriformis, pour s’unir à la veine fémorale commune en formant une crosse. À ce niveau existe une valvule, dite ostiale car située à son origine, empêchant le sang veineux de la veine fémorale commune de refluer dans la saphène interne. La veine saphène interne reçoit tout au long de son trajet de nombreuses veines collatérales superficielles. L’incontinence de cette valvule peut obliger le retrait chirurgical de cette veine saphène au niveau de la crosse (éveinage et crossectomie).
- La veine saphène externe naît au niveau de la malléole externe (excroissance osseuse de la partie inférieure et externe du péroné situé juste au-dessus de la cheville) puis chemine à la face postérieure de la jambe pour s’aboucher par une crosse dans la veine poplitée. Cependant son anatomie est très inconstante et sa terminaison variable (saphène interne, fémorale profonde, fémorale superficielle).
- Par ailleurs, il peut exister une veine saphène accessoire ou veine de Giacomini reliant la veine saphène interne et la veine saphène externe.
Épidémiologie
[modifier | modifier le code]La thrombose veineuse profonde est une maladie relativement fréquente. Elle survient dans 90 % des cas au niveau des membres inférieurs avec une fréquence plus élevée pour le membre inférieur gauche ; dans les 10 % restant elle touche le membre supérieur, le pelvis, la cavité abdominale, le thorax, la tête et le cou. Son incidence est estimée à 1,5 cas par an et par 1 000 personnes[2]. Elle s’accroît avec l’âge pour atteindre un taux de 3 nouveaux cas par an et par 1 000 personnes chez les octogénaires. Elle est légèrement plus fréquente chez l’homme.
Causes ou facteurs de risque
[modifier | modifier le code]Elle débute par un caillot dans le système veineux des membres inférieurs. La formation de ce caillot est favorisée par :
- la stase veineuse, provoquée par une immobilité entraînant la perte de l’effet de pompe musculaire. Cette stase est particulièrement prononcée en cas d’alitement prolongé, par exemple au cours d'une hospitalisation[3], mais aussi en cas d’immobilisation longue : plâtre ou long voyage en avion (généralement supérieur à 8 heures, d'où l'expression impropre du « syndrome de la classe économique » car il touche toutes les classes[4]) ou en voiture[5]. Elle peut être favorisée par un bas débit sanguin sur une insuffisance cardiaque ;
- un traumatisme local, même minime[6] ;
- des anomalies biologiques acquises : modifications hormonales (en particulier association estroprogestatifs, type pilule, et tabac), maladies inflammatoires, cancers (une maladie cancéreuse est découverte dans environ 10 % des phlébites sans circonstance déclenchante nette[7]), etc.
- des anomalies biologiques constitutionnelles (de naissance) : déficit en certains facteurs : AT3, protéines C et S, facteur Leiden (appelé aussi résistance à la protéine C activée), etc. Cette dernière anomalie étant de loin la plus courante. Ces déficits vont provoquer une maladie thromboembolique récidivante nécessitant un traitement à vie. Elles doivent être systématiquement recherchées en cas d’accidents répétés sans cause habituelle retrouvée. À noter que la prescription d’anticoagulants va perturber le dosage de ces éléments qui ne peut donc être fait qu’avant tout traitement ou à l’arrêt de ce dernier.
La phlébite est quatre fois plus fréquente chez la femme enceinte[8]. Les raisons de cette augmentation importante du risque sont variables : état d’hypercoagulabilité[9] et stase sanguine dans les veines des membres inférieurs[10].
La survenue d'une phlébite semble, d'autre part, être corrélée avec une infection, une transfusion sanguine récente ou avec l'emploi d'érythropoïétine (EPO)[11].
Diagnostic
[modifier | modifier le code]Clinique
[modifier | modifier le code]
Le tableau clinique classique de la thrombose veineuse profonde (à l'exception de la phlébite asymptomatique) comprend trois symptômes importants : une douleur aiguë (de type crampe, pesanteur) d'un mollet ; un mollet plus chaud ; un mollet augmenté de volume avec présence du signe de « Homans » : la dorsiflexion du pied exacerbe la douleur. Les signes sont cependant souvent frustes et, dans une proportion importante, inexistants[12].
On peut palper parfois un cordon induré, sous la peau, de la thrombose dans le cas d’une thrombose veineuse superficielle. Cette dernière est beaucoup moins grave car, en règle générale, elle n’évolue pas vers l’embolie pulmonaire.
Plusieurs diagnostics différentiels sont à évoquer :
- un hématome profond : dû à un traumatisme, une déchirure musculaire (claquage). Dans ce cas, le traitement anticoagulant va aggraver les signes cliniques en favorisant le saignement ;
- un érysipèle : maladie infectieuse sous-cutanée de la jambe qui devient chaude, rouge, œdématiée et s’accompagne volontiers de signes généraux comme de la fièvre (39 à 40 °C) ;
- une maladie post-phlébitique : jambe sensible, avec souvent des varices apparentes, parfois avec une peau de coloration brunâtre (dermite ocre). Le doppler veineux ne retrouve aucun thrombus mais des séquelles d’une phlébite ancienne : dilatation et incontinence valvulaire veineuse ;
- la rupture d’un kyste poplité qui donne un tableau clinique assez similaire avec dans certains cas un caractère inflammatoire plus marqué.
Biologie
[modifier | modifier le code]Le dosage des D-dimères, produits de dégradation de la fibrine qui est l’un des éléments constitutif majeur du caillot, permet de faire un diagnostic d’élimination : un taux bas rend très peu probable l’hypothèse d’une maladie thromboembolique[13], mais un taux élevé ne permet pas de conclure puisque toute maladie, un tant soit peu inflammatoire, en augmente son taux sérique. Par ailleurs ce dosage biologique a moins de valeur, passé 70 ans, les taux pouvant être élevés à ces âges sans signification pathologique et donc ininterprétables. Or il faut se souvenir que la maladie thromboembolique affecte plus particulièrement les personnes âgées.
La mesure du TCK et du TP-INR sont des tests de la coagulabilité sanguine. Ils sont faits de manière systématique afin de vérifier l’absence de maladie de la coagulation, avant de commencer le traitement anticoagulant.
Suivant le tableau, on peut rechercher d’emblée une anomalie constitutionnelle de la coagulation.
Imagerie
[modifier | modifier le code]La preuve de la thrombose veineuse profonde ne sera apportée que si l’on visualise le caillot.
- L’échographie Doppler veineux : fait par des médecins angiologues[réf. nécessaire], il permet de visualiser et de situer précisément les limites du caillot. C’est un examen simple, en règle générale indolore, dénué de dangers et extrêmement fiable. Il est cependant un peu plus limité si le thrombus est haut situé (iliaque ou cave) car ces structures sont difficiles à bien visualiser. Certains indices permettent de dater l'ancienneté du caillot[14] (veine de petit calibre, non compressible, caillot hyperéchogène...)
- La phlébographie : c’était jusqu’à une époque récente l’examen de référence. On injectait un produit iodé dans les veines du dos des pieds et on prenait une série de clichés radiographiques. On pouvait compléter l’examen par une cavographie par injection directe dans la veine fémorale au pli de l’aine. Cet examen comporte les risques de toute injection de produits de contraste : allergie, insuffisance rénale. Il pouvait provoquer lui-même une thrombose veineuse. Cet examen est, en pratique courante, abandonné.
- Plus accessoirement, le scanner avec injection permet de bien visualiser la veine cave. Il peut être complété par un scanner thoracique permettant de faire un diagnostic d’embolie pulmonaire.
Évolution de la thrombose veineuse profonde
[modifier | modifier le code]Sous un traitement bien conduit, la thrombose veineuse profonde guérit dans la grande majorité des cas sans séquelles.
Il existe cependant trois types de complications :
- l’embolie pulmonaire, qui, dans près de la moitié des cas, est totalement asymptomatique (le patient ne se plaint de rien et l’embolie pulmonaire n’est découverte que lors d’un examen systématique)[15] ;
- l’extension : le thrombus croît et remonte dans le système veineux, augmentant le risque d’embolie pulmonaire ;
- la maladie post phlébitique : l’occlusion partielle ou totale du réseau veineux profond fait que c’est le réseau superficiel qui prend en charge le retour veineux. Les veines superficielles se dilatent, les valvules devenant alors incontinentes. C’est la formation des varices avec leur cortège fonctionnel : douleurs, jambes lourdes, troubles trophiques cutanés, œdèmes… Ces modifications accroissent la stase et sont le lit aux récidives phlébitiques. C'est une complication fréquente, près d'un tiers des patients se plaignant de certains de ces symptômes[16].
La récidive d'une nouvelle phlébite est toujours possible malgré un traitement bien conduit : elle se produit chez près d'un quart des patients, cinq ans après le premier épisode[17]. Elle est plus fréquente si aucun facteur favorisant n'a été identifié[18], ou si la thrombose a concerné les veines iliaques ou cave[19].
Rarement un thrombus peut migrer à travers une communication droite-gauche intracardiaque (de naissance) et donner une embolie artérielle : il s’agit d’une embolie paradoxale.
Traitement
[modifier | modifier le code]
Plusieurs recommandations ont été publiées pour la prise en charge de cette maladie. Celles de l'American College of Chest Physicians datent de 2012[20], celles de l'« European Society of Cardiology », de 2018[21].
L’hospitalisation n’est pas nécessaire si la thrombose veineuse est simple et les conditions satisfaisantes pour un traitement à domicile[22].
En règle générale, on emploie un traitement par un anticoagulant oral direct. Le dabigatran[23], le rivaroxaban[24] et l'apixaban[25] ont démontré une efficacité au moins identique au traitement conventionnel. Seuls le rivaroxaban et l'apixaban ont l'autorisation de mise sur le marché dans cette indication. Une alternative consiste en l'emploi d'héparine par voie sous cutanée (Héparine de bas poids moléculaire ou HBPM) en une injection, ou en perfusion continue, avec un relais par antivitamine K (AVK), débuté dès le premier jour. Les HBPM ne seront arrêtés que lorsque ces derniers sont efficaces et après 3 jours de chevauchement une fois l’INR cible atteint (entre 4 et 8 jours après le début du traitement).
Le lever est autorisé dès le deuxième ou troisième jour.
Une contention veineuse (bandes ou bas à varices) est mise en place si possible au premier jour et sinon au moins pour le lever. Cette contention contraint le retour veineux à se faire par le réseau profond. Elle accélère la reperméabilisation de ce dernier. Elle doit être absolument posée avant tout lever (sauf toilette et besoin urgent) et être gardée la journée et doit être portée plusieurs mois. Elle ne semble cependant pas efficace dans la prévention de la maladie post-phlébitique[26].
Les anticogulants oraux sont continués plusieurs mois. Dans certains cas ils seront prescrits à vie (présence d’une anomalie constitutionnelle de la coagulation ou phlébite récidivante).
En cas d’emploi d’œstroprogestatifs (pilule ou traitement substitutif de la ménopause), le choix de ces derniers devra être revu par le gynécologue.
Le tabac est fortement déconseillé.
Dans de rares cas (si les anticoagulants oraux sont contre-indiqués ou si la maladie thromboembolique récidive malgré une anticoagulation bien conduite), on peut alors proposer la pose d’un filtre cave :
- Une « ombrelle » est montée dans la veine cave par ponction veineuse basse (fémorale) ou haute (jugulaire) en position sous rénale. Cette ombrelle bloque théoriquement les caillots qui ne peuvent plus remonter dans les artères pulmonaires.
- Le risque de thrombose de la veine cave est grand avec des conséquences fonctionnelles notables (maladie post phlébitique bilatérale importante).
La fibrinolyse consiste à injecter dans la veine occluse un médicament thrombolytique dissolvant le caillot et permettant de rouvrir le vaisseau avec une plus grande probabilité qu'avec le simple traitement anticoagulant[27]. Le risque hémorragique est cependant notable.
En cas de syndrome des antiphospholipides, les antivitamines K sont préférés, car ils ont alors une meilleure efficacité que les anticoagulants oraux directs[28].
En cas de cancer, une anticoagulation par une héparine de bas poids moléculaire en une seule injection (tinzaparine est préférée[29] mais les anticoagulants oraux directs pourraient avoir une place[30],[31].
Traitement préventif
[modifier | modifier le code]Dans certaines situations, le risque de survenue de phlébite est majoré et justifie, par conséquent, un traitement préventif. Ce risque peut atteindre 40 à 80 % après une chirurgie de la hanche ou du genou et est aux alentours de 10 à 20 % lors d’un simple alitement au cours d’une hospitalisation[32].
Le traitement préventif repose sur un lever précoce, le port éventuel d’une contention élastique des membres inférieurs (bas à varices, appelés également bas de compression ou bas de contention dont l’efficacité est démontrée dans les suites d’une chirurgie[33] mais pas dans l’accident vasculaire cérébral[34]) et sur l’administration d’héparines à bas poids moléculaire qui peuvent être relayées par des anti-vitamines K suivant la hauteur du risque. Idéalement, la contention élastique doit être haute, c’est-à-dire concerner cuisse et mollet[35]. Une technique alternative pourrait être la compression intermittente des membres inférieurs par pompe[36]. Ce système diminue la stase veineuse et activerait la fibrinolyse locale[37]. Il est néanmoins peu aisé à appliquer et parfois peu confortable, entraînant un emploi non optimal[38].
L’aspirine ne semble pas avoir démontré d’efficacité en prévention à long terme chez les personnes à bas risque de faire une phlébite[39]. Elle pourrait être une alternative au traitement par héparine de bas poids moléculaire après chirurgie orthopédique[40]. En prévention secondaire, elle pourrait réduire le risque de récidive après arrêt des anticoagulants oraux[41].
Une alternative aux HBPM et aux AVK peut être la prescription d'un inhibiteur direct de la thrombine comme le dabigatran[42] ou un inhibiteur oral du facteur Xa comme le rivaroxaban[43].
Cas particuliers
[modifier | modifier le code]Thrombose veineuse des membres supérieurs
[modifier | modifier le code]Elle est plus rare, représentant environ 10 % des phlébites et favorisée par certains gestes médicaux (pose d'un stimulateur cardiaque, d'une voie veineuse centrale, surtout si elle est prolongée) et par certains cancers[44].
Elle peut être favorisée également par un effort important (on parle alors de syndrome de Paget-Schroetter (en)), avec, fréquemment, un syndrome du défilé costo-claviculaire sous-jacent (compression de la veine sous-clavière par la clavicule, la première côte et le muscle sous-clavier)[45].
Un cancer est plus fréquemment retrouvé que lors d'une phlébite du membre inférieur[46].
La phlébite du membre supérieur se manifeste par une lourdeur du bras, voire une douleur, des paresthésies. L'examen clinique peut révéler un œdème localisé, la dilatation des veines superficielles.
Un cas particulier est le syndrome de la veine cave supérieure résultant de l'occlusion de cette dernière.
La survenue d'une embolie pulmonaire est plus rare qu'avec une phlébite du membre inférieur. La récidive est également peu fréquente[47]. Par contre, l'évolution vers une maladie post-phlébitique est fréquente mais les statistiques sont très variables selon les études (entre 7 et 46 %)[48].
Le diagnostic est fait par échographie Doppler veineuse. Le traitement repose sur les mêmes principes que lors d'une phlébite du membre inférieur : anticoagulation pendant au moins trois mois. Le retrait du cathéter est recommandé. S'il n'est pas possible, l'anticoagulation devra être prolongée[45].
Phlébite bleue
[modifier | modifier le code]La phlébite bleue, ou « phlegmasia coerulea dolens » est une forme grave de phlébite, avec ischémie du membre pouvant conduire à l'amputation sans prise en charge correcte.
Maladie de Mondor
[modifier | modifier le code]La maladie de Mondor est une thrombophlébite des veines au niveau de la face antérieure du thorax.
Voir aussi
[modifier | modifier le code]
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
Articles connexes
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- Dans cette thrombophlébite, le processus thrombotique prédomine sur celui de l'inflammation de la paroi veineuse, contrairement à la thrombose veineuse superficielle, appelée aussi phlébite superficielle. Source : Michel Perrin, Phlébologie, Elsevier Masson, , p. 13.
- Nordstrom M, Lindblad B, Bergqvist D, Kjellstrom T, A prospective study of the incidence of deep-vein thrombosis within a defined urban population, J Intern Med, 1992;232:155-60
- Cohen AT, Tapson VF, Bergmann JF et al. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinational cross-sectional study, Lancet, 2008;371:387-394
- Dr Jean-François Van Cleef, chef de service de médecine vasculaire de l'institut Arthur Vernes, intervention dans l'émission Pourquoi, Docteur ? sur Europe 1, 7 juillet 2013
- (en) Chandra D, Parisini E, Mozaffarian D, Meta-analysis: Travel and risk for venous thromboembolism, Ann Intern Med, 2009.
- (en)van Stralen KJ, Rosendaal FR, Doggen CJM, Minor injuries as a risk factor for venous thrombosis, Arch Intern Med, 2008;168:21-26.
- (en) Carrier M, Le Gal G, Wells PS, Fergusson D, Ramsay T, Rodger MA, Systematic Review: The Trousseau Syndrome Revisited: Should We Screen Extensively for Cancer in Patients with Venous Thromboembolism?, Ann Intern Med, 2008;149:323-333.
- (en) Heit JA, Kobbervig CE, James AH et als. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study, Ann Intern Med, 2005;143:697-706.
- (en) Brenner B, Haemostatic changes in pregnancy, Thromb Res, 2004;114:409-414.
- (en) Macklon NS, Greer IA, Bowman AW, An ultrasound study of gestational and postural changes in the deep venous system of the leg in pregnancy, Br J Obstet Gynaecol, 1997;104:191-197.
- Rogers MAM, Levine DA, Blumberg N, Flanders SA, Chopra V, Langa KM, Triggers of hospitalization for venous thromboembolism, Circulation, 2012;125:2092– 2099
- Pierce Grace et Neil R. Borley, Chirurgie, De Boeck Supérieur, , p. 43
- Wells PS, Anderson DR, Rodger M et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis, N Engl J Med, 2003;349:1227-35
- Gornik HL, Sharma AM, Duplex ultrasound in the diagnosis of lower-extremity deep venous thrombosis, Circulation, 2014;129:917-921
- (en) Meignan M, Rosso J, Gauthier H et als. Systematic lung scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous thrombosis, Arch Intern Med, 2000;160:159-164.
- Kahn SR, Shrier I, Julian JA, Ducruet T et al. Determinants and time course of the postthrombotic syndrome after acute deep venous thrombosis, Ann Intern Med, 2008;149:698-707
- Prandoni P, Noventa F, Ghirarduzzi A et al. The risk of recurrent venous thromboembolism after discontinuing anticoagulation in patients with acute proximal deep vein thrombosis or pulmonary embolism, A prospective cohort study in 1626 patients, Haematologica, 2007;92:199-205
- White RH, Murin S, Wun T, Danielsen B, Recurrent venous thromboembolism after surgery: provoked versus unprovoked thromboembolism, J Thromb Haemost, 2010;8:987–997
- Douketis JD, Crowther MA, Foster GA, Ginsberg JS, Does the location of thrombosis determine the risk of disease recurrence in patients with proximal deep vein thrombosis?, Am J Med, 2001;110:515–519
- Kearon C, Akl EA, Comerota AJ et al. Antithrombotic therapy for VTE disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest, 2012;141:e419S-e494S
- Mazzolai L, Aboyans V, Ageno W et al. Diagnosis and management of acute deep vein thrombosis: a joint consensus document from the European Society of Cardiology working groups of aorta and peripheral vascular diseases and pulmonary circulation and right ventricular function, Eur Heart J, 2018;39:4208-4218
- Othieno R, Abu Affan M, Okpo E. Home vs in-patient treatment for deep vein thrombosis, Cochrane Database Syst Rev, 2007;3(3):CD003076
- Schulman S, Kearon C, Kakkar AK et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism, N Engl J Med, 2009;361:2342-2352
- The EINSTEIN Investigators, Oral rivaroxaban for symptomatic venous thromboembolism, N Engl J Med, 2010;363:2499-2510
- Agnelli G, Buller HR, Cohen A et al. Oral apixaban for the treatment of acute venous thromboembolism, N Engl J Med, 2013;369:799-808
- Kahn SR, Shapiro S, Wells PS et al. Compression stockings to prevent post-thrombotic syndrome: a randomised placebo-controlled trial, Lancet, 2013. doi:10.1016/S0140-6736(13)61902-9
- Enden T, Haig Y, Kløw NE et al. Long-term outcome after additional catheter-directed thrombolysis vs standard treatment for acute iliofemoral deep vein thrombosis (the CaVenT study): a randomised controlled trial, Lancet, 2012;379:31-38
- Pengo V, Denas G, Zoppellaro G et al. Rivaroxaban vs warfarin in high-risk patients with antiphospholipid syndrome, Blood, 2018;132:1365-1371
- Lee AYY, Kamphuisen PW, Meyer G et al. Tinzaparin vs warfarin for treatment of acute venous thromboembolism in patients with active cancer: a randomized clinical trial, JAMA, 2015;314:677-686
- Young AM, Marshall A, Thirlwall J et al. Comparison of an oral factor Xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT-D), J Clin Oncol, 2018;36:2017-2023
- Agnelli G, Becattini C, Meyer G et al. Apixaban for the treatment of venous thromboembolism associated with cancer, N Engl J Med, 2020;382:1599-1607
- (en) Geerts WH, Pineo GF, Heit JA et als. Prevention of venous thromboembolism: the seventh ACCP conference on antithrombotic and thrombolytic therapy, Chest 2004;126(suppl 3):338-400S.
- (en) Amaragiri SV, Lees T, Elastic compression stockings for prevention of deep vein thrombosis, Cochrane Database Syst Rev, 2000 1. CD001484.
- (en)The CLOTS Trials Collaboration. Effectiveness of thigh-length graduated compression stockings to reduce the risk of deep vein thrombosis after stroke (CLOTS trial 1): a multicentre, randomised controlled trial, Lancet 2009:373;1958-1965.
- (en) Sajid MS, Tai NR, Goli G et Als. Knee versus thigh length graduated compression stockings for prevention of deep venous thrombosis: a systematic review, Eur J Vasc Endovasc Surg, 2006;32:730-6.
- CLOTS (Clots in Legs Or sTockings after Stroke) trials collaboration, Effectiveness of intermittent pneumatic compression in reduction of risk of deep vein thrombosis in patients who have had a stroke (CLOTS 3): a multicentre randomised controlled trial, Lancet, 2013;382:516-524
- Kohro S, Yamakage M, Sato K, Sato JI, Namiki A, Intermittent pneumatic foot compression can activate blood fibrinolysis without changes in blood coagulability and platelet activation, Acta Anaesthesiol Scand, 2005;49:660-664
- Bockheim HM, McAllen KJ, Baker R, Barletta JF, Mechanical prophylaxis to prevent venous thromboembolism in surgical patients: a prospective trial evaluating compliance, J Crit Care, 2009;24:192-196
- (en) Glynn RJ, Ridker PM, Goldhaber SZ, Buring JE, Effect of low-dose aspirin on the occurrence of venous thromboembolism, Ann Intern Med, 2007;147:525-533.
- Anderson DR, Dunbar MJ, Bohm ER et al. Aspirin versus Low-Molecular-Weight Heparin for extended venous thromboembolism prophylaxis after total hip arthroplasty: A randomized trial, Ann Intern Med, 2013;158:800-806
- Becattini C, Agnelli G, Schenone A et al. the WARFASA Investigators, Aspirin for preventing the recurrence of venous thromboembolism, N Engl J Med, 2012;366:1959-1967
- Eriksson BI, Dahl OE, Rosencher N et Als. Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial, J Thromb Haemost, 2007;5:2178–2185
- Turpie AGG, Lassen MR, Davidson B et Als. Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial, Lancet, 2009;373:1673-1680
- Joffe HV, Kucher N, Tapson VF, Goldhaber SZ, Upper-extremity deep vein thrombosis: a prospective registry of 592 patients, Circulation, 2004;110:1605–1611
- Engelberger P, Kucher N, Management of deep vein thrombosis of the upper extremity, Circulation, 2012;126:768-773
- (en) Girolami A, Prandoni P, Zanon E, Bagatella P, Girolami B, Venous thromboses of upper limbs are more frequently associated with occult cancer as compared with those of lower limbs, Blood Coagul Fibrinolysis, 1999;10:455–457
- (en) Lechner D, Wiener C, Weltermann A, Eischer L, Eichinger S, Kyrle PA, Comparison between idiopathic deep vein thrombosis of the upper and lower extremity regarding risk factors and recurrence, J Thromb Haemost, 2008;6:1269–1274
- (en) Elman EE, Kahn SR, The post-thrombotic syndrome after upper extremity deep venous thrombosis in adults: a systematic review, Thromb Res, 2006;117:609–614