Difluor
| Difluor | |
| |
| Identification | |
|---|---|
| Nom UICPA | difluor |
| No CAS | |
| No ECHA | 100.029.049 |
| No CE | 231-954-8 |
| PubChem | |
| SMILES | |
| Apparence | gaz comprimé, jaune, d'odeur âcre[1] |
| Propriétés chimiques | |
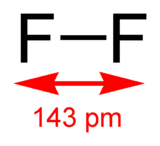
| Formule | F2 [Isomères] |
| Masse molaire[2] | 37,996 806 4 ± 1,0E−6 g/mol F 100 %, |
| Propriétés physiques | |
| T° fusion | −219 °C[1] |
| T° ébullition | −188 °C[1] |
| Solubilité | dans l'eau : réaction[1] |
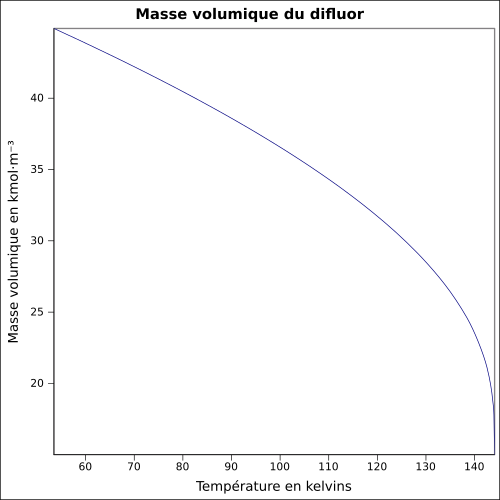
| Masse volumique | liq. à −188,13 °C : 1,512 7 g·cm-3
|
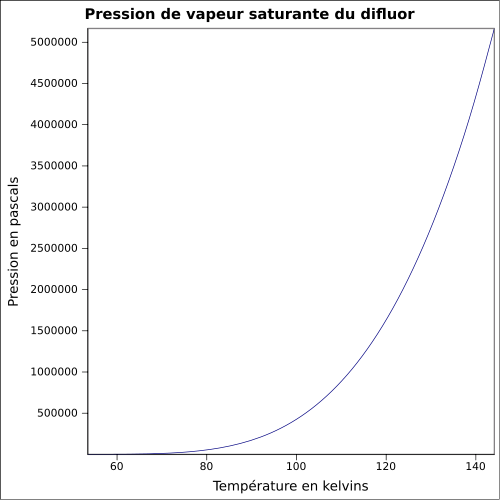
| Pression de vapeur saturante | |
| Point critique | 52,2 bar, −128,85 °C[4] |
| Thermochimie | |
| ΔvapH° | 6,62 kJ·mol-1 (1 atm, −188,12 °C)[5] |
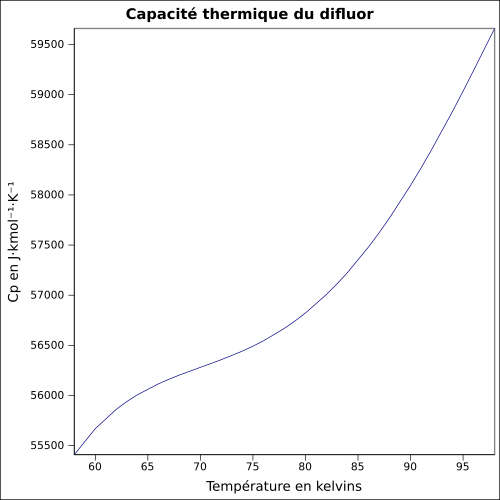
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 15,697 ± 0,003 eV (gaz)[6] |
| Précautions | |
| SGH[7] | |
| H270, H314 et H330 |
|
| SIMDUT[8] | |
    A, D1A, E, F, |
|
| NFPA 704 | |
| Inhalation | irritation, spasmes bronchiaux, œdème pulmonaire |
| Peau | brûlures |
| Yeux | irritation, brûlures |
| Ingestion | taches dentaires, ostéosclérose |
| Écotoxicologie | |
| CL50 | rat 185 ppm (volume), souris 150 ppm, cochon d'Inde 170 ppm |
| Seuil de l’odorat | bas : 0,09 ppm haut : 0,19 ppm[9] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le difluor (F2) est un corps simple diatomique, dont les molécules sont constituées de deux atomes de fluor.
Dans les conditions normales de température et de pression, le difluor est un gaz jaune pâle, d'odeur irritante, difficile à liquéfier. Il attaque les muqueuses, la peau, les dents et les yeux. Le difluor est l'un des corps les plus réactifs de toute la chimie, toutes ses réactions sont fortement exothermiques. Il réagit pratiquement avec toutes les substances sauf trois gaz rares (l'hélium, le néon et l'argon), quelques polymères organiques fluorés (notamment les téflons) et certains alliages spéciaux. Associé à d'autres composants chimiques, dont l'isopropanol, il entre dans la fabrication du gaz sarin.
Ce gaz fut isolé en 1886 par le chimiste français Henri Moissan.

Articles connexes[modifier | modifier le code]
Références[modifier | modifier le code]
- FLUOR, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008)
- « Fluor » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- « Fluorine », sur hazmap.nlm.nih.gov (consulté le )