Concanavaline A
| Concanavaline A | ||
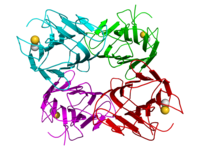 Structure cristallographique du tetramère de concanavaline A du haricot sabre : les monomères sont colorés en cyan, vert, rouge, et magenta respectivement. Les ions calcium et Manganese sont représentés comme des sphères en couleurs or et gris[1]. | ||
| Caractéristiques générales | ||
|---|---|---|
| UniProt | P81461 | |
| PDB | 3CNA | |
La concanavaline A ou ConA, est une glycoprotéine de la famille des lectines. Elle se lie spécifiquement au D-mannose et au D-glucose.
Cette molécule est une héma-glutinine, c’est à dire qu’elle a la capacité à précipiter les globules rouges. Elle peut être utilisée en comme un réactif en biochimie, en immunologie et en chromatographie d’affinité des glycoprotéines et structures cellulaires (pour purifier la chromatographie)[2].
Origine[modifier | modifier le code]
La concanavaline A est produite par le haricot sabre, Canavalia ensiformis, où elle s'accumule dans le fruit ou fève. C'est la première lectine à avoir été identifiée et extraite par Peter Hermann Stillmark en 1888 à l'Université de Dorpat en Russie. Elle est aussi appelée hémaglutinine, en raison de sa capacité à précipiter les érythrocytes, mais diffère de l'hémaglutinine (HA) du virus de la grippe.
Le haricot sabre contient deux autres globulines lectines : la concanavaline B de 96KDa, et la jacaline.
Structure et propriétés[modifier | modifier le code]
Comme la majorité des lectines, la ConA est un homotétramère : chaque sous-unité de 26.5KDa composée de 237 acides aminés et fortement glycosylée, héberge deux ions, un de Ca2+ et un d'un métal de transition, généralement du Mn2+. Sa structure tertiaire a été élucidée[3], et l'on connait bien les bases moléculaires de ses interactions avec les métaux qui la composent, et de son affinité pour le mannose et le glucose[4]
La ConA est spécifique des résidus α-D-mannosyl et α-D-glucosyl, deux hexoses ne différant que par la disposition de l'alcool sur le carbone 2, lorsqu'ils se situent en position terminale de structures ramifiées de N-Glycanes, comme celles riches en α-mannose, ou celles de type hybride bi-antennaire de glycanes complexes. La ConA a 4 sites de fixation, correspondants aux 4 sous unités.
Le poids moléculaire est de 104-113KDa [5]. Le point isoélectrique est de l'ordre de 4.5-5.5.
La ConA a une faible effet de Diffusion Raman, 20 cm-1 [6]. Cette émission est due à la faible mobilité du tonneau β formé de 14 feuillets β dans la structure de la ConA[7].
Activité[modifier | modifier le code]
- La ConA interagit avec divers récepteurs contenant des polysaccharides à mannose, à commencer par les marqueurs de groupe sanguin, les immunoglobulines et l'antigène carcino-embryonnaire ou ACE. Elle interagit aussi avec les lipoprotéines[8] et le lipopolysaccharide (LPS)[9].
- La ConA agglutine fortement les érythrocytes, sans en être spécifique de groupe sanguin, et aussi les cellules cancéreuses[9]. Les cellules normales ne sont pas agglutinées, sauf après traitement hydrolytique ou trypsinisation[9]. De nombreuses études rapportent l'agglutination de types cellulaires comme les lymphocytes, les fibroblastes, les adipocytes[9].
- La ConA réagit avec de nombreux micro-organismes, comme E. coli, Dictyostelium discoideum et B. substilis [9].
- La ConA induit la mitose des lymphocytes[9].
Elle induit la maturation des oocystes [9]. Elle est supposée médier l'interaction entre les oligosaccharides (alpha-mannosyl) de la surface du virus HIV et les lymphocytes T humains[9].
Notes et références[modifier | modifier le code]
- PDB 3CNA; (en) Hardman KD, Ainsworth CF, « Structure of concanavalin A at 2.4-A resolution », Biochemistry, vol. 11, no 26, , p. 4910–9 (PMID 4638345, DOI 10.1021/bi00776a006)
- Cours de médecine de première année
- (en) W Min et al., EMBO J. 11 (1992) 1303-1307; et Modèle de structure de la Concanavalin A
- (en) R Loris, T Hamelryck, J Bouckaert, L Wyns (1998); Legume lectin structure, Biochim. Biophys. Acta 1383(1988): 9–36
- (en) J.B.Summer et al. (1938); J.B.Summer et al.; JBC 1938; "The molecular Weights of canavalin, concanavalin A, and Concanavalin B"
- (en) Painter PC, Mosher LE, Rhoads C, « Low-frequency modes in the Raman spectra of proteins », Biopolymers, vol. 21, no 7, , p. 1469–72 (PMID 7115900, DOI 10.1002/bip.360210715)
- (en) Chou KC, « Low-frequency motions in protein molecules. Beta-sheet and beta-barrel », Biophys. J., vol. 48, no 2, , p. 289–97 (PMID 4052563, PMCID 1329320, DOI 10.1016/S0006-3495(85)83782-6)
- (en) J A Harmony and E H Cordes (1975); The Journal of Biological Chemistry, N.250. No.22, Issue 01, pp. 8614-8617. 1975; "Native human plasma low density lipoprotein (LDL) interacts with concanavalin A but not with ricin"
- ConA technical information, from Interchim
