Spiropentane
| Spiropentane | |

| |
| Structure du spiropentane | |
| Identification | |
|---|---|
| Nom UICPA | spiro[2.2]pentane |
| No CAS | |
| PubChem | 9088 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H8 [Isomères] |
| Masse molaire[1] | 68,117 ± 0,004 6 g/mol C 88,16 %, H 11,84 %, |
| Propriétés physiques | |
| T° fusion | −107,0 °C[2] |
| T° ébullition | 39,5-40,5 °C[3] à 746 Torr |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le spiropentane est un hydrocarbure de formule chimique C5H8. C'est le plus simple des cycloalcanes spiro et des triangulanes[4],[5],[6],[7]. Plusieurs années ont été nécessaires depuis sa découverte en 1887 pour déterminer sa structure[8],[9],[10]. Son nom systématique est spiro[2.2]pentane mais, comme il ne peut avoir d'autre spiropentane isomère, son nom simple sans chiffres ni crochets est non ambigu.
-
Représentation 3D du spiropentane.
Synthèse[modifier | modifier le code]
Après avoir produit du cyclopropane en faisant réagir du 1,3-dibromopropane avec du zinc métallique finement divisé, Gustavson a tenté la même réaction avec du 2,2-bis(bromoéthyl)-1,3-dibromopropane. La substance de départ s'obtient facilement en faisant réagir du pentaérythritol avec de l'acide bromhydrique. Cela donne un composé de formule C5H8, nommé vinyltriméthylène dans la publication initiale[11]. Fecht postula en 1907 qu'il devait s'agir de spiropentane, isomère du vinylcyclopropane[12]. Un autre indice appuyant la structure de l'hydrocarbure vient du fait qu'il a également pu être obtenu à partir de 1,1-bis(bromoéthyl)cyclopropane[13].

Le spiropentane est difficile à séparer des autres produits de réaction, et les premières procédures aboutissaient à des mélanges impurs. Des décennies plus tard, la méthode de production a été améliorée. L'hydrocarbure spiro peut être séparé des sous-produits (2-méthyl-1-butène, 1,1-diméthylcyclopropane, méthylènecyclobutane) par distillation[3].
Propriétés[modifier | modifier le code]
La caractérisation structurelle par diffraction électronique a montré que la longueur des liaisons C–C n'est pas la même avec l'atome de carbone quaternaire (centre spiro) qu'entre les groupes méthylène : elle vaut 146,9 pm avec l'atome central contre 151,9 pm entre les groupes CH2–CH2. L'angle C–C–C au niveau du centre spiro vaut 62,2°, ce qui est plus élevé que dans le cyclopropane[14].
Le chauffage de molécules de spiropentane marquées avec des atomes de deutérium permet de mettre en évidence une topomérisation ou « stéréomutation » semblable à celle du cyclopropane : le cis-1,2-dideutériospiropentane s'équilibre ainsi avec le trans-1,2-dideutériospiropentane[15].

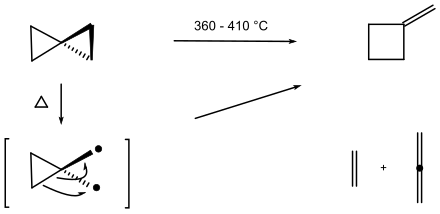
Gustavson a rapporté en 1896 que le chauffage du spiropentane à 200 °C le convertissait en d'autres hydrocarbures. Une thermolyse en phase gazeuse de 360 à 410 °C conduit à une expansion du cycle en l'isomère méthylènecyclobutane, ainsi que les produits de fragmentation éthylène et propadiène. Il est probable que la liaison la plus longue — et la plus faible — soit rompue en premier, formant un intermédiaire diradical[15].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, « Properties of the Elements and Inorganic Compounds », CRC Handbook of Chemistry and Physics, 90e éd., Taylor & Francis, 2009, p. 5-20. (ISBN 978-1420090840)
- (en) Douglas E. Applequist, George F. Fanta et Bertel W. Henrikson, « Chemistry of Spiropentane. I. An Improved Synthesis of Spiropentane », The Journal of Organic Chemistry, vol. 23, no 11, , p. 1715-1716 (DOI 10.1021/jo01105a037, lire en ligne)
- (en) Jerry Donohue, George L. Humphrey et Verner Schomaker, « The Structure of Spiropentane », Journal of the American Chemical Society, vol. 67, no 2, , p. 332-335 (DOI 10.1021/ja01218a056, lire en ligne)
- (en) M. J. Murray et Eugene H. Stevenson, « Spiropentane », Journal of the American Chemical Society, vol. 66, no 2, , p. 314 (DOI 10.1021/ja01230a515, lire en ligne)
- (en) M. J. Murray et Eugene H. Stevenson, « The Debromination of Pentaerythrityl Bromide by Zinc. Isolation of Spiropentane », Journal of the American Chemical Society, vol. 66, no 5, , p. 812-816 (DOI 10.1021/ja01233a047, lire en ligne)
- (en) J. E. Price, K. A. Coulterpark, T. Masiello, J. W. Nibler, A. Weber, A. Maki et T. A. Blake, « High-resolution infrared spectra of spiropentane, C5H8 », Journal of Molecular Spectroscopy, vol. 269, no 1, , p. 129-136 (DOI 10.1016/j.jms.2011.05.011, Bibcode 2011JMoSp.269..129P, lire en ligne)
- (de) O. Philipow, « Die Konstitution der Kohlenwasserstoffe Gustavsons: Vinyltrimethylen und Äthylidentrimethylen », Journal für Praktische Chemie, vol. 93, no 1, , p. 162-182 (DOI 10.1002/prac.19160930112, lire en ligne)
- (de) Al. Faworsky et W. Batalin, « Über das Vinyltrimethylen und Äthyliden-trimethylen von Gustavson », Berichte der deutschen chemischen Gesellschaft, vol. 47, no 2, , p. 1648-1651 (DOI 10.1002/cber.19140470250, lire en ligne)
- (en) G. R. Burns et D. G. McGavin, « Infrared and Raman Spectra of Spiropentane-H8 », Applied Spectroscopy, vol. 26, no 5, , p. 540-542 (DOI 10.1366/000370272774351778, Bibcode 1972ApSpe..26..540B, S2CID 95384874, lire en ligne)
- (de) G. Gustavson, « Ueber Aethylidentrimethylen », Journal für Praktische Chemie, vol. 54, no 1, , p. 104-107 (DOI 10.1002/prac.18960540106, lire en ligne)
- (de) H. Fecht, « Über Spirocyclane », Berichte der deutschen chemischen Gesellschaft, vol. 40, no 3, , p. 3883-3891 (DOI 10.1002/cber.190704003194, lire en ligne)
- (de) N. Zelinsky, « Über das Spirocyclan, seine Synthese und sein Verhalten bei der Reduktionskatalyse », Berichte der deutschen chemischen Gesellschaft, vol. 46, no 1, , p. 160-172 (DOI 10.1002/cber.19130460128, lire en ligne)
- (en) G. Dallinga, R. K. van der Draai et Miss L. H. Toneman, « Electron diffraction by gases: The molecular structure of spiropentane », Recueil des Travaux Chimiques des Pays-Bas, vol. 87, no 8, , p. 897-905 (DOI 10.1002/recl.19680870805, lire en ligne)
- (en) Joseph J. Gajewski et Leo T. Burka, « Alkyl shifts in thermolyses. V. Thermal epimerization of the 1,4-dimethylspiropentanes », Journal of the American Chemical Society, vol. 94, no 25, , p. 8857-8860 (DOI 10.1021/ja00780a035, lire en ligne)