Halogénation de Hell-Volhard-Zelinski
L'halogénation de Hell-Volhard-Zelinski est une réaction qui permet d'introduire un ou plusieurs atomes d'halogènes dans des acides carboxyliques au niveau du carbone en α. La réaction porte le nom de trois chimistes, les Allemands Carl Magnus von Hell (1849-1926) et Jacob Volhard (1834-1910) et le Russe Nikolaï Zelinski (1861-1953)[1],[2],[3].

Un exemple d'utilisation de la réaction de Hell-Volhard-Zelinski peut être vu dans la préparation d'alanine. Une approche utilisant une synthèse de Strecker[4] a été décrite comme "excellente mais fastidieuse" et ainsi une alternative commençant par l'acide propanoïque a été développée. Dans sa première étape, une combinaison de brome et de tribromure de phosphore (catalyseur) est utilisée pour préparer l'acide 2-bromopropanoïque[5], qui est ensuite converti en un racémique du produit d'acide aminé par ammonolyse[6],[7].
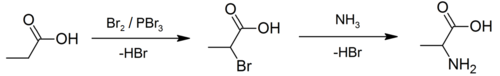
Mécanisme[modifier | modifier le code]
Contrairement à d'autres réactions d'halogénation, cette réaction a lieu en l'absence de support halogène. La réaction commence par addition d'une quantité catalytique de PBr3, après quoi un équivalent molaire de Br2 est ajouté.
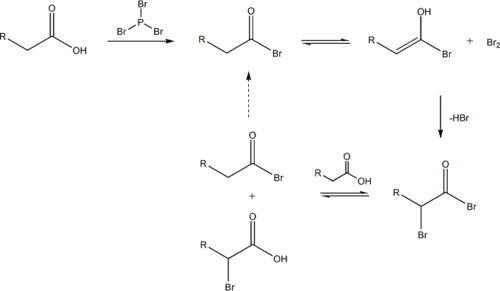
PBr3 remplace l'OH carboxylique par un bromure, ce qui donne un bromure d'acide carboxylique. Le bromure d'acyle peut ensuite se tautomériser en un énol, qui réagit facilement avec le Br2 pour bromer une deuxième fois en position α.
Dans une solution aqueuse neutre à légèrement acide, l'hydrolyse du bromure d'α-bromo acyle se produit spontanément, donnant l'acide α-bromo carboxylique dans un exemple d'une substitution nucléophile d'acyle. Si une solution aqueuse est souhaitable, un équivalent molaire total de PBr3 doit être utilisé lorsque la chaîne catalytique est perturbée.
Si peu de solvant nucléophile est présent, la réaction du bromure d'α-bromo acyle avec l'acide carboxylique donne le produit acide α-bromo carboxylique et régénère l'intermédiaire de bromure d'acyle. En pratique, un équivalent molaire de PB3 est souvent utilisé de toute façon pour surmonter la cinétique de réaction lente.
Le mécanisme d'échange entre un bromure d'alcanoyle et un acide carboxylique est ci-dessous. Le bromure d'α-bromoalcanoyle a un carbone carbonyle fortement électrophile en raison des effets mésomères attracteurs d'électrons des deux bromures.

Références[modifier | modifier le code]
- (de) von Hell, « Ueber eine neue Bromirungsmethode organischer Säuren », Berichte, vol. 14, , p. 891–893 (DOI 10.1002/cber.188101401187, lire en ligne)
- (de) Volhard, « Ueber Darstellung α-bromirter Säuren », Annalen der Chemie, vol. 242, nos 1–2, , p. 141–163 (DOI 10.1002/jlac.18872420107, lire en ligne)
- (de) Zelinsky, « Ueber eine bequeme Darstellungsweise von α-Brompropionsäureester », Berichte, vol. 20, , p. 2026 (DOI 10.1002/cber.188702001452, lire en ligne)
- dl-Alanine, Org. Synth. 9, coll. « vol. »,
- α-Bromoisovaleric acid, Org. Synth. 11, coll. « vol. »,
- Tobie et Ayres, « Synthesis of d,l-Alanine in Improved Yield from α-Bromopropionic Acid and Aqueous Ammonia », Journal of the American Chemical Society, vol. 59, no 5, , p. 950 (DOI 10.1021/ja01284a510)
- dl-Alanine, Org. Synth., coll. « vol. »,

