Complexe péridinine-chlorophylle-protéine
| Pfam | PF02429 |
|---|---|
| InterPro | IPR003376 |
| SCOP | 1ppr |
| SUPERFAMILY | 1ppr |
Le complexe péridinine-chlorophylle-protéine (PCP, ou PerCP), est un complexe moléculaire soluble formé par une protéine creuse en forme de barque contenant de la chlorophylle a, de la péridinine et un diglycéride. La péridinine absorbe la lumière bleu-vert dans les longueurs d'onde de 470 à 550 nm, où l'absorption par la chlorophylle a et la chlorophylle b est faible, et transfère l'énergie lumineuse absorbée aux molécules de chlorophylle avec une très grande efficacité[1]. Les complexes PCP sont présents chez de nombreux dynoflagellés photosynthétiques, chez lesquels ils peuvent être les principaux complexe collecteurs de lumière[2].
Le complexe PCP a été identifié dans le génome des dinoflagellés sous au moins deux formes : une forme homodimérique constituée de deux monomères de 15 kDa, et une forme monomérique d'environ 32 kDa dont on pense qu'elle a évolué à partir de la forme homodimérique par duplication de gènes. La forme monomérique consiste en deux domaines pseudosymétriques de huit hélices α chacun assemblées en une configuration ressemblant à celle des feuillets β du repliement jelly roll[1]. La disposition des hélices dessine une forme en barque ou en ravier avec une grande cavité centrale contenant des pigments photosynthétiques et des lipides. Chaque domaine à huit hélices se lie généralement à une molécule de chlorophylle a, quatre molécules de péridinine et une molécule de lipide comme une digalactosyl-diglycéride ; cette stœchiométrie varie cependant selon les espèces et selon les isoformes de PCP[2],[3].
Le ratio 4:1 entre la péridinine et la chlorophylle a a été prédit par spectroscopie dans les années 1970[4], et a été confirmé par caractérisation de la structure du complexe PCP d’Amphidinium carterae (en) dans les années 1990[1]. Qu'il s'agisse de la forme monomérique ou dimérique, le complexe protéine-pigment est parfois appelé bPCP (pour l'anglais buiding block) est en forme l'unité structurelle minimale. Dans au moins certains cas, dont celui d’A. carterae, ces unités bPCP s'assemblent en trimères sont on pense qu'ils sont l'état fonctionnel normal.



-
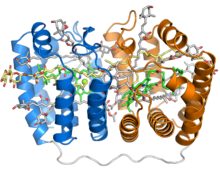
Représentation du trimère dont on pense qu'il est la forme biologiquement active du complexe PCP d'A. carterae (en). Seule la protéine est représentée pour les monomères en haut et à droite, tandis que l'ensemble des éléments du complexe sont représentés pour le monomère inférieur gauche (PDB 1PPR[1])
La résolution de la structure tridimensionnelle du complexe PCP révélée par cristallographie aux rayons X en 1997 a introduit un nouveau mode de repliement des protéines appelé solénoïde α par la base de données CATH (en), bien que la littérature désigne également sous ce terme des structures moins compactes quelque peu différentes[5].
Les dinoflagellés photosynthétiques contiennent des complexes membranaires collecteurs de lumière semblables à ceux des plantes vertes. Ils possèdent également des complexes hydrophiles protéine-pigment qui utilisent des caroténoïdes pour étendre le spectre d'absorption des seules chlorophylles. La péridinine absorbe ainsi la lumière dans les longueurs d'onde où les chlorophylles sont peu efficaces (470 à 550 nm). La liaison de ces différents pigments dans le complexe PCP assure un arrangement tridimensionnel qui optimise les transferts d'énergie des péridinines vers les molécules de chlorophylle voisines[2],[3].
Le complexe PCP est un modèle couramment utilisé en spectroscopie et pour les modélisations numériques de la photophysique des protéines[6]. On pense que les complexes PCP se trouvent dans le lumen des thylakoïdes, d'où ils transfèrent l'énergie captée leurs pigments aux complexes photosynthétiques membranaires[3].
Notes et références[modifier | modifier le code]
- (en) Eckhard Hofmann, Pamela M. Wrench, Frank P. Sharples, Roger G. Hiller, Wolfram Welte et Kay Diederichs, « Structural Basis of Light Harvesting by Carotenoids: Peridinin-Chlorophyll-Protein from Amphidinium carterae », Science, vol. 272, no 5269, , p. 1788-1791 (PMID 8650577, DOI 10.1126/science.272.5269.1788, Bibcode 1996Sci...272.1788H, lire en ligne)
- (en) Jing Jiang, Hao Zhang, Yisheng Kang, David Bina, Cynthia S. Lo et Robert E. Blankenship, « Characterization of the peridinin–chlorophyll a-protein complex in the dinoflagellate Symbiodinium », Biochimica et Biophysica Acta (BBA) - Bioenergetics, vol. 1817, no 7, , p. 983-989 (PMID 22497797, PMCID 3947849, DOI 10.1016/j.bbabio.2012.03.027, lire en ligne)
- (en) Tim Schulte, Silke Johanning et Eckhard Hofmann, « Structure and function of native and refolded peridinin-chlorophyll-proteins from dinoflagellates », European Journal of Cell Biology, vol. 89, no 12, , p. 990-997 (PMID 20846743, DOI 10.1016/j.ejcb.2010.08.004, lire en ligne)
- (en) Pill-Soon Song, Prasad Koka, Barbara B. Prezelin et Francis T. Haxo, « Molecular topology of the photosynthetic light-harvesting pigment complex, peridinin-chlorophyll a-protein, from marine dinoflagellates », Biochemistry, vol. 15, no 20, , p. 4422-4427 (PMID 987799, DOI 10.1021/bi00665a012, lire en ligne)
- (en) Mark C. Field, Andrej Sali et Michael P. Rout, « On a bender—BARs, ESCRTs, COPs, and finally getting your coat », Journal of Cell Biology, vol. 193, no 6, , p. 963-972 (PMID 21670211, PMCID 3115789, DOI 10.1083/jcb.201102042, lire en ligne)
- (en) Donatella Carbonera, Marilena Di Valentin, Riccardo Spezia et Alberto Mezzetti, « The Unique Photophysical Properties of the Peridinin-Chlorophyll-a-Protein », Current Protein and Peptide Science, vol. 15, no 4, , p. 332-350 (PMID 24678668, PMCID 4030626, DOI 10.2174/1389203715666140327111139, lire en ligne)

![Représentation du trimère dont on pense qu'il est la forme biologiquement active du complexe PCP d'A. carterae (en). Seule la protéine est représentée pour les monomères en haut et à droite, tandis que l'ensemble des éléments du complexe sont représentés pour le monomère inférieur gauche (PDB 1PPR[1])](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3e/1ppr_peridinin_chlorophyll_protein_trimer.png/577px-1ppr_peridinin_chlorophyll_protein_trimer.png)