Méthoxyméthane
| Méthoxyméthane | |
| Identification | |
|---|---|
| Nom UICPA | méthoxyméthane |
| Synonymes |
oxybisméthane ; éther diméthylique ; éther méthylique ; oxyde de diméthyle |
| No CAS | |
| No ECHA | 100.003.696 |
| No CE | 204-065-8 |
| No RTECS | PM4780000 |
| PubChem | 8254 |
| ChEBI | 28887 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore avec une odeur d'éther[1],[2] |
| Propriétés chimiques | |
| Formule | C2H6O [Isomères] |
| Masse molaire[4] | 46,068 4 ± 0,002 3 g/mol C 52,14 %, H 13,13 %, O 34,73 %, |
| Moment dipolaire | 1,30 ± 0,01 D [3] |
| Propriétés physiques | |
| T° fusion | −141,5 °C[1],[2],[5] |
| T° ébullition | −23,6 °C[1],[5] −24,82 °C[2],[5] |
| Solubilité | dans l'eau : 24 g·l-1[1] |
| Masse volumique | 1,91855 g/L à 1 atm et 25 °C[5] gaz 2,11 g/L à 1013 hPa et 0 °C[2]gaz 0,74 g·cm−3 à −25 °C[2] liquide |
| T° d'auto-inflammation | 350 °C[1],[5] |
| Point d’éclair | −42 °C[5] |
| Limites d’explosivité dans l’air | 3,4–26,7 %vol[1],[5] |
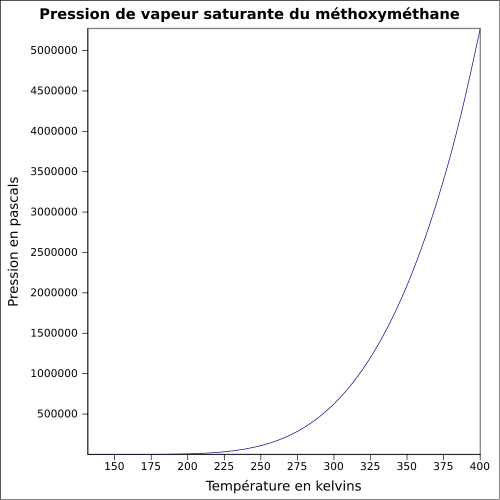
| Pression de vapeur saturante | 4450 mmHg à 25 °C[5] 510 kPa à 20 °C[2] |
| Point critique | 52,4 bar, 126,85 °C [7] |
| Thermochimie | |
| Cp | |
| PCS | 1 460,4 kJ·mol-1 (25 °C, gaz)[9] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,025 ± 0,025 eV (gaz)[10] |
| Précautions | |
| SGH[11],[2],[5] | |
| H220, H280, H336, P210, P261, P271, P312, P377, P381, P304+P340, P403, P405, P403+P233, P410+P403 et P501 |
|
| NFPA 704[5] | |
| Écotoxicologie | |
| CL50 | 385,94 ppm (30 min) (souris, Inhalation)[5] 494,36 ppm (15 min) (souris, Inhalation)[5] 308,5 mg/L (4 h) (rat, Inhalation)[5] 164,000 ppm (4 h) (rat, Inhalation)[5] |
| LogP | 0,10 (octanol/eau)[1],[5] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le méthoxyméthane, appelé aussi éther méthylique ou bien encore diméthyléther (DME), est un composé chimique de formule semi-développée CH3OCH3. Il fait partie de la famille des éthers.
Synthèse[modifier | modifier le code]
Il peut être synthétisé en chauffant un mélange d'acide sulfurique très concentré et de méthanol. Il est produit à partir de gaz naturel par un procédé de déshydratation du méthanol.
Utilisation[modifier | modifier le code]
Il est utilisé comme biocarburant par des entreprises pétrolières telles que Total.
Accident[modifier | modifier le code]
Le , un nuage de méthoxyméthane échappé d'un wagon-citerne explose dans une usine de la BASF à Ludwigshafen (Allemagne) tuant 207 personnes et en blessant 3 818 (effet thermobarique et intoxications par divers produits chimiques)[13] .
Détection astrophysique[modifier | modifier le code]
Grâce à son moment dipolaire non négligeable (µ = 1,30 D), le diméthyléther est un bon candidat pour une recherche par spectroscopie rotationnelle avec une importante densité spectrale centrée autour de 1 THz à une température de 150 K. Il a ainsi été détecté en grande abondance dans le milieu interstellaire[14] et même dans le nuage de Magellan, c'est-à-dire en dehors de la Voie lactée[15]. Il s'agit de l'une des plus grosses molécules organiques complexes observées[16] (9 atomes) et son processus de formation reste encore mal compris. En effet, le modèle de chimie en phase gazeuse ne permet pas de reproduire cette abondance : la chimie sur les grains de poussière est alors communément admise.
L'observation et l'étude de telles molécules permet ainsi de mieux appréhender la formation des différentes molécules importantes pour la chimie prébiotique.
Notes et références[modifier | modifier le code]
- ETHER DIMETHYLIQUE, Fiches internationales de sécurité chimique
- Entrée « Methoxymethane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8/01/2008 (JavaScript nécessaire)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID 8254
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9, LCCN 96051648), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 978-0-88415-857-8, LCCN 96036328)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « oxyde de diméthyle », sur ESIS, consulté le 15 février 2009
- (de) Besatzungs-Schäden: Im Gesetz nicht vorgesehen, Der Spiegel, 1958 , n° 2. Voir aussi de:Kesselwagenexplosion_in_der_BASF.
- (en) L. E. Snyder et al., « Radio detection of interstellar dimethyl ether », ApJ, vol. 191, , p. L79
- (en) Marta Sewiło, Remy Indebetouw, Steven B. Charnley, Sarolta Zahorecz, Joana M. Oliveira et al., « The Detection of Hot Cores and Complex Organic Molecules in the Large Magellanic Cloud », The Astrophysical Journal Letters, (lire en ligne)
- « Molecules in the Interstellar Medium or Circumstellar Shells (en date du 11/2012) »