Bisphosphoglycérate mutase
| Bisphosphoglycérate mutase | ||
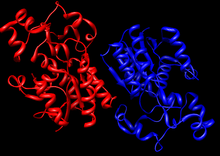
 Dimère de bisphosphoglycérate mutase humaine (PDB 2H4Z) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | BPGM | |
| N° EC | 5.4.2.4 | |
| Homo sapiens | ||
| Locus | 7q33 | |
| Masse moléculaire | 30 005 Da[1] | |
| Nombre de résidus | 259 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
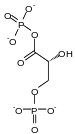
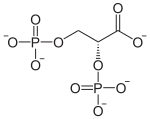
La bisphosphoglycérate mutase (BPGM) est une enzyme spécifique aux érythrocytes et aux cellules du placenta catalysant l'isomérisation du 1,3-bisphospho-D-glycérate (1,3-BPG) produit au cours de la glycolyse en 2,3-bisphospho-D-glycérate, qui a la propriété de stabiliser la forme désoxy de l'hémoglobine et donc de rendre plus efficace le transport de l'oxygène dans le sang sous faible pression partielle d'O2 en adaptant la courbe d'affinitité en conséquence.
Cette réaction n'est physiologiquement utile qu'en présence d'hémoglobine, où le 2,3-BPG a pour effet de provoquer la libération de l'oxygène lié à l'oxyhémoglobine en stabilisant la désoxyhémoglobine. C'est la raison pour laquelle on ne trouve la BPGM que dans les érythrocytes et le placenta : dans ce dernier, il permet de mettre de plus grandes quantités d'oxygène à disposition du fœtus.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Références
[modifier | modifier le code]- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) Wang Y, Wei Z, Bian Q, Cheng Z, Wan M, Liu L, Gong W, « Crystal structure of human bisphosphoglycerate mutase », J. Biol. Chem., vol. 279, no 37, , p. 39132–8 (PMID 15258155, DOI 10.1074/jbc.M405982200)