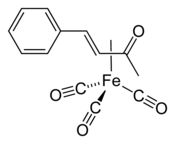
(Benzylidèneacétone)fer tricarbonyle
| (Benzylidèneacétone)fer tricarbonyle | ||
| ||
 | ||
| Structure et cristaux du (benzylidèneacétone)fer tricarbonyle | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| PubChem | 11403415 | |
| SMILES | ||
| InChI | ||
| Apparence | solide rouge cristallisé | |
| Propriétés chimiques | ||
| Formule | C13H10FeO4 |
|
| Masse molaire[1] | 286,061 ± 0,014 g/mol C 54,58 %, H 3,52 %, Fe 19,52 %, O 22,37 %, |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le (benzylidèneacétone)fer tricarbonyle est un composé organofer de formule chimique (η4-C6H5CH=CHC(O)CH3)Fe(CO)3, parfois abrégée (bda)Fe(CO)3. Il se présente comme un solide rouge cristallisé et est utilisé comme source d'unités Fe(CO)3[2]. Il s'agit d'un complexe en tabouret de piano avec une liaison haptique entre l'atome de fer et une cétone. Il est caractérisé par des raies spectrales infrarouges à 2065, 2005 et 1985 cm−1 dans le cyclohexane, ces trois raies indiquant le faible degré de symétrie du complexe, qui est chiral. On peut l'obtenir par réaction du nonacarbonyle de difer Fe2(CO)9 sur la benzylidèneacétone C6H5CH=CHC(O)CH3[3].
Réactions[modifier | modifier le code]
La (bda)Fe(CO)3 peut réagir avec une base de Lewis pour donner des adduits sans déplacement de la benzylidèneacétone[5]. Les réactifs du type (bda)Fe(CO)2(PR3) agissent comme sources de "Fe(CO)2(PR3)", où R représente par exemple un résidu aryle[6].
D'autres sources de Fe(CO)3 sont par exemple le nonacarbonyle de difer Fe2(CO)9 et le complexe Fe(CO)3(cyclooctène)2, ce dernier étant très réactif et sensible à la chaleur. Les dérivés imine de l'aldéhyde cinnamique C6H5CH=CHCHO tels que C6H5CH=CHC(H)=NC6H5 forment également des adduits réactifs avec Fe(CO)3, aux propriétés plus intéressantes à certains égards que (bda)Fe(CO)3[7].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Hans-Joachim Knölker, « (η4-Benzylideneacetone)tricarbonyliron », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rb058, lire en ligne).
- (en) A. J. P. Domingos, J. A. S. Howell, B. F. G. Johnson, J. Lewis, N. Grice et R. Pettit, « Reagents for the Synthesis of η-Diene Complexes of Tricarbonnyliron and Tricarbonylruthenium », Inorganic Syntheses: Reagents for Transition Metal Complex and Organometallic Syntheses, vol. 28, (DOI 10.1002/9780470132593.ch11, lire en ligne).
- (en) E. J. M. Hamilton, D. E. Smith et A. J. Welch, « Structure of (benzylideneacetone)tricarbonyliron (monoclinic form) », Acta Crystallographica Section C: Structural Chemistry, vol. 43, , p. 1212-1213 (DOI 10.1107/S0108270187092473, lire en ligne).
- (en) James A.S. Howell, John C. Kola, Denis T. Dixon, Philip M. Burkinshaw et Marion J. Thomas, « The kinetics and mechanism of diene exchange in (η4-enone)Fe(CO)2L complexes (L = phosphine, phosphite) », Journal of Organometallic Chemistry, vol. 266, no 1, , p. 83-96 (DOI 10.1016/0022-328X(84)80113-8, lire en ligne).
- (en) Brian F. G. Johnson, Jack Lewis, G. Richard Stephenson et Eduardo J. S. Vichi, « Preparation and reactions of triphenylphosphine and triphenyl phosphite complexes of (benzylideneacetone)dicarbonyliron(0) », Journal of the Chemical Society, Dalton Transactions, no 5, , p. 369-373 (DOI 10.1039/DT9780000369, lire en ligne).
- (en) Hans-Joachim Knölker, Arnold Braier, Dirk J. Bröcher, Simon Cämmerer, Wolfgang Fröhner, Peter Gonser, Holger Hermann, Daniela Herzberg, Kethiri R. Reddy et Guy Rohde, « Recent applications of tricarbonyliron-diene complexes to organic synthesis », Pure and Applied Chemistry, vol. 73, no 7, , p. 1075-1086 (DOI 10.1351/pac200173071075, S2CID 98692646, lire en ligne).

![Structure 3D déterminée par cristallographie (forme monoclinique)[4].](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3a/%28bda%29Fe%28CO%293-from-xtal-Mercury-3D-bs1.png/421px-%28bda%29Fe%28CO%293-from-xtal-Mercury-3D-bs1.png)