Orthophosphate de fer
| Orthophosphate de fer | |
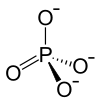  |
|
| Structure moléculaire du phosphate de fer(III) (en haut) et échantillon du pentahydrate (en bas). | |
| Identification | |
|---|---|
| Synonymes |
phosphate de fer(III) |
| No CAS | (anhydre) (dihydrate) (tétrahydrate) |
| No ECHA | 100.030.123 |
| No CE | 233-149-7 (anhydre) |
| PubChem | 24861 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche jaunâtre, inodore[1] |
| Propriétés chimiques | |
| Formule | FePO4.2H2O |
| Masse molaire[2] | 186,847 ± 0,004 g/mol H 2,16 %, Fe 29,89 %, O 51,38 %, P 16,58 %, |
| Propriétés physiques | |
| Solubilité | anhydre : insol. in eau, dihydrate :6,42 g·l-1 à 100 °C[3], sol dans les acides minéraux[1] |
| Masse volumique | 2,87 g·cm-3 à 20 °C[4] |
| Précautions | |
| SGH[5] | |
| H315, H319, H335, P261 et P305+P351+P338 |
|
| Écotoxicologie | |
| DL50 | > 5 000 mg/kg (rat, oral)[1] > 5 000 mg/kg (rat, cutané)[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'orthophosphate de fer, le phosphate de fer III ou l'orthophosphate de fer hydraté, est des sels de fer III existant naturellement dans la nature.
Ils sont notamment utilisés comme pesticide minéral pour leurs propriétés molluscicides (permettant de lutter contre les limaces et escargots).
Structure[modifier | modifier le code]
La forme la plus commune du phosphate de fer III adopte la structure de l'α-quartz dans laquelle les atomes de phosphore et de fer sont dans une géométrie tétraédrique. À haute pression, la structure se transforme en une plus dense avec des centres de fer octaédriques. Deux autres phases orthorhombiques et une monoclinique sont connues. Dans les deux polymorphes du dihydrate, les centres Fe (III) sont octaédriques avec deux ligands eau en position cis[6].
Propriétés biologiques[modifier | modifier le code]
Ingéré par les gastéropodes terrestres, c'est un molluscicide qui provoque rapidement leur mort en bloquant leur mode d'alimentation.

D'origine naturelle, il n’est pas réputé toxique pour les vers de terre, les insectes et les oiseaux et n'a pas d'effets sur les hérissons et la plupart des animaux communs. Il est néanmoins irritant pour la peau, les voies respiratoires et plus particulièrement les yeux.
Utilisation[modifier | modifier le code]
Il est largement utilisé sous différentes formes[7],[8] pour lutter contre les limaces et les escargots dans les jardins[9].
Utilisable en agriculture biologique, c'est un des seuls moyens curatif efficace de se prémunir contre les dégâts dans les jardins potagers et ornementaux.
Notes et références[modifier | modifier le code]
- (pdf) fiche Orthophosphate de fer dihydraté sur afpp.net.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche iron(III) phosphate dihydrate sur chemister.ru.
- Fiche Sigma-Aldrich du composé Iron(III) phosphate, consultée le 18 juillet 2017.
- Fiche Sigma-Aldrich du composé Iron(III) phosphate dihydrate, consultée le 18 juillet 2017.
- K. Zaghib, C. M. Julien, Structure and electrochemistry of FePO4·2H2O hydrate, Journal of Power Sources, 2005, vol. 142, pp.: 279–284. DOI 10.1016/j.jpowsour.2004.09.042.
- (pdf) fiche Ferramol
- (pdf) fiche Compo
- ’efficacité sur salade de l'orthophosphate de fer par le GRAB PACA 2006

