Pipérylène
| 1,3-Pentadiène | |||
  |
|||
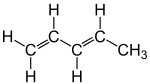
| Structures du trans-1,3-pentadiène (à gauche) et du cis-1,3-pentadiène (à droite) | |||
| Identification | |||
|---|---|---|---|
| No CAS | (mélange trans+cis) (isomère trans) (isomère cis) |
||
| No ECHA | 100.007.269 | ||
| No CE | 207-995-2 (mélange trans+cis) 217-909-5 (isomère trans) 216-401-0 (isomère cis) |
||
| No RTECS | RZ2465000[1] | ||
| PubChem | 62204 (mélange trans+cis) 62204 (isomère trans) 643785 (isomère cis) |
||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C5H8 [Isomères] |
||
| Masse molaire[2] | 68,117 ± 0,004 6 g/mol C 88,16 %, H 11,84 %, |
||
| Propriétés physiques | |||
| T° fusion | −87 °C[1] | ||
| T° ébullition | 42 °C[1] | ||
| Masse volumique | 0,678 g·cm-3[1] à 20 °C | ||
| Point d’éclair | −15 °C[1] | ||
| Précautions | |||
| SGH[1] | |||
| H225, H304, H315, H319, H335, P210, P280, P331, P301+P310, P337+P313 et P403+P235 |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le pipérylène est un mélange de deux stéréoisomères de 1,3-pentadiène CH3=CH–CH=CH–CH3. Il se présente sous la forme d'un liquide incolore combustible et toxique.
On peut obtenir du pipérylène par méthylation du 1,3-butadiène avec du diméthylsulfoxyde CH3SOCH3 (DMSO) en présence d'une base telle que le tert-butylate de potassium K+(CH3)3CO− pour donner un mélange d'environ 80 % d'isomères trans et 20 % d'isomères cis. Il est également possible de passer par une réaction de Wittig depuis l'acétaldéhyde CH3CHO, l'acroléine CH2=CH–CHO ou le crotonaldéhyde H3C–CH=CH–CHO, avec des rendements et un rapport cis/trans dépendant de nombreux facteurs, tels que la substance de départ et le solvant utilisé. On peut en outre l'obtenir par élimination de Hofmann à partir de pipéridine C5H10NH, qui donne du 1,4-pentadiène CH2=CH–CH2–CH=CH2 par méthylations répétées suivies de l'élimination de la triméthylamine N(CH3)3 formée ; le 1,4-pentadiène obtenu par ce procédé s'isomérise spontanément en pipérylène dans les conditions de la réaction[3]. Le pipérylène est également un sous-produit du processus de séparation de la coupe en C5 des gaz de pyrolyse (en) ainsi que de la production d'éthylène CH2=CH2.
Le pipérylène peut être utilisé pour préparer d'autres composés tels que le 2-méthylfurane, ainsi que comme monomère pour produire des matières plastiques, des adhésifs et des résines. Des substances à base de pipérylène sont par exemple utilisées dans les adhésifs modernes tels que ceux des enveloppes, des bandes adhésives pour emballages ou des fermetures pour couches-culottes.
Notes et références[modifier | modifier le code]
- Fiche Sigma-Aldrich du composé trans-1,3-Pentadiene 90%, consultée le 16 juin 2018.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Albert Gossauer, Struktur und Reaktivität der Biomoleküle, John Wiley & Sons, 2003, p. 255. (ISBN 3-906390-29-2)




