Milieu Kligler Hajna
Le milieu de Kligler-Hajna est un milieu de culture permettant la recherche simultanée de :
- l'utilisation du lactose ;
- la fermentation du glucose ;
- la production d'H2S ;
- la production de gaz ;
- la lysine décarboxylase ;
- la β-galactosidase pour les bactéries lactose - (test ONPG).
Composition[modifier | modifier le code]
- Peptone ......................... 15 g - Extrait de viande ............... 3 g - Extrait de levure ............... 3 g - Peptone pepsique de viande ...... 5 g - Glucose ......................... 1 g - Lactose ......................... 10 g - Rouge de phénol ................. 25 mg - Chlorure de sodium .............. 5 g - Sulfate ferreux (*).............. 0,2 g - Thiosulfate de sodium ........... 0,3 g - Agar-agar ....................... 11 g
(*) ou citrate de fer III
pH = 7,5
Les peptones sont riches en lysine. Le milieu est conditionné en tubes avec une pente et un culot.
Ensemencement[modifier | modifier le code]
- La pente doit être abondamment ensemencée (stries serrées ou goutte de suspension).
- Le culot est ensemencé par simple piqûre.
Incubation : 37 °C pendant 18 à 24 h (ne pas dépasser ce délai) après avoir dévissé le bouchon partiellement ce qui permet les échanges gazeux.
Lecture, interprétation[modifier | modifier le code]
Utilisation des glucides[modifier | modifier le code]

Pour pouvoir utiliser le lactose, une bactérie doit posséder deux enzymes (schéma ci-contre) :
- Une β-galactoside perméase (1) ;
- Une β-galactosidase (2) .
Il s'ensuit une série de réactions de dégradation du glucose (3) conduisant à la production d'énergie E.
Le glucose inhibe la synthèse de ces deux enzymes. C'est ce que l'on appelle l'effet glucose. En effet, l'utilisation des glucides suit la loi de diauxie, l'utilisation du lactose n'aura lieu qu'après épuisement du glucose. Or, le glucose est en faible quantité par rapport au lactose et la pente est ensemencée abondamment.
La pente (en aérobiose) et le culot (en anaérobiose relative) sont interprétés indépendamment.
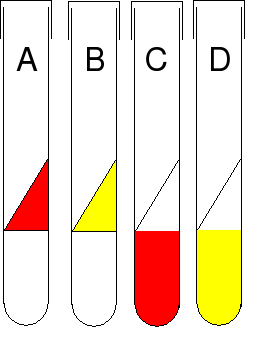
Interprétation de la pente[modifier | modifier le code]
- Dans un premier temps, les bactéries utilisent le glucose comme source de carbone et d'énergie (à cause de l'effet glucose). Cette utilisation s'accompagne de la production de dioxyde de carbone d'acides organiques d'où le virage du rouge au jaune du milieu (figure 1A). Cette acidification est limitée, le dioxyde de carbone n'étant pas très acidifiant et volatil (bouchon débouché).
- Dans un second temps, du fait du développement rapide (en aérobiose) et de la faible concentration en glucose en moins de 24 heures, la totalité du glucose est dégradé, il y a disparition de l'effet glucose. Puis, deux possibilités :
- Si la bactérie est β-galactoside perméase + ET β-galactosidase + : les bactéries utilisent le lactose avec production d'acides organiques : le virage au jaune est confirmé (figure 1B).
- Si la bactérie est β-galactoside perméase + et β-galactosidase - OU β-galactoside perméase - et β-galactosidase - : les bactéries ne peuvent pas utiliser le lactose. Les bactéries utilisent alors comme source de carbone et d'énergie les peptones (qui ne sont dégradables qu'en conditions aérobies) : le métabolisme protique libère des produits basiques (ammoniac, amines...) d'où une recoloration au rouge de la pente (figure 1).
Ainsi :
- Pente rouge : bactérie lactose - (figure 1A- figure 2.2 et 2.3) ;
- Pente jaune : bactérie lactose + (figure 1B - figure 2.1).

Figure 2 - Trois tubes de milieu de Kligler Hajna incubés 24 h à 37 °C avec en 1 une souche lactose + gaz + glucose fermenté, en 2 une souche lactose - glucose fermenté et en 3 une souche lactose -, glucose probablement fermenté, H2S +
Interprétation du culot[modifier | modifier le code]
- Dans un premier temps, les bactéries fermentent le glucose avec production importante d'acides organiques (à cause de l'effet glucose) (figure 1D).
- Comme sur la pente, en moins de 24 heures, tout le glucose est fermenté. Cependant, si les bactéries sont lactose -, l'utilisation des peptones avec une alcalinisation ne permet pas le revirage de l'indicateur de pH car les acides produits par la fermentation sont suffisamment acide pour neutraliser les produits issus de la fermentation des peptones, le culot restera jaune en 24 h (figure 1D).
- Si la bactérie n'est pas capable de fermenter le glucose, il n'y a pas production d'acides organiques, le culot reste rouge (figure 1C). C'est en particulier le cas des aérobies strictes.
Ainsi :
Production de gaz[modifier | modifier le code]
La production de gaz lors de l'utilisation des glucides est mise en évidence par le décollement de la gélose et/ou des bulles dans la gélose. (On parle aussi de « fragmentation » de la gélose). S'il n'y a pas ces témoins de dégagement gazeux, la bactérie est gaz - .
Production de sulfure d'hydrogène[modifier | modifier le code]
Elle a lieu à partir de l'ion thiosulfate : . Le sulfure d'hydrogène réagit avec les ions fer III (Fe3+) du citrate de fer III pour former un précipité de sulfure de fer III noir. Ainsi :
- Bactéries H2S + : précipité noir ;
- Bactéries H2S - : pas de précipité noir.
Présence d'une lysine décarboxylase (technique historique)[modifier | modifier le code]
La lysine décarboxylase (LDC) décarboxyle la lysine présente dans le milieu en cadavérine (=1,6-diaminopentane, amine très apolaire en milieu basique) soluble dans le chloroforme (trichlorométhane). La ninhydrine permet de mettre en évidence la cadavérine.
- Verser 1 mL de potasse (1 mol/L) sur la pente du milieu de Kligler.
- Verser 1 mL de chloroforme et laisser décanter.
- Prélever la phase chloroformique (en bas) et verser dans un tube à hémolyse en verre (ou en plastique résistant au chloroforme).
- Ajouter quelques gouttes de ninhydrine (en solution chloroformique à 1 g/L) dans le tube à hémolyse.
- Incuber quelques minutes au bain d'eau à 37 °C.
- Lecture :
Les acides aminés n'interfèrent pas sur la réaction car, en milieu basique, ils sont polaires donc insolubles dans un solvant apolaire comme le chloroforme.
Problème : l'utilisation du chloroforme est fortement déconseillée en raison de la toxicité de ce solvant. La technique, décrite pour son intérêt historique, ne doit pas être réalisée.
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Joffin Jean-Noël, Leyral Guy, Dictionnaire des Techniques, CRDP d'Aquitaine réseau Canopé, 2014, 5e édition, 418 p. (ISBN 978-2-8661-7515-3)



