« Oxalate de diphényle » : différence entre les versions
m →Utilisations : 3 --> é |
→Utilisations : + La réaction passe par un biradical oxalate paramagnétique<ref> |
||
| Ligne 168 : | Ligne 168 : | ||
L'oxalate de diphényle est un important [[précurseur (chimie)|précurseur]] dans la synthèse du [[carbonate de diphényle]]<ref name="RömppOnline" />. |
L'oxalate de diphényle est un important [[précurseur (chimie)|précurseur]] dans la synthèse du [[carbonate de diphényle]]<ref name="RömppOnline" />. |
||
C'est un des composants utilisé des les [[Bâton lumineux|bâtons lumineux]] (« glowsticks »), ces produits d'[[oxydation]] |
C'est un des composants utilisé des les [[Bâton lumineux|bâtons lumineux]] (« glowsticks »), ces produits d'[[oxydation]] |
||
étant responsables de la [[chimiluminescence]].<ref name="Francis Rouessac, Annick Rouessac">{{ouvrage| auteur=Francis Rouessac, Annick Rouessac | titre=Chemical Analysis Modern Instrumentation Methods and Techniques | éditeur=John Wiley & Sons | isbn=978-1-118-68187-9 | année=2013}}</ref>. Par réaction avec le [[peroxyde d'hydrogène]], il se forme la [[1,2-Dioxétanedione|1,2-dioxétanedione]] ainsi que deux molécules de [[phénol (molécule)|phénol]]<ref>{{article|nom1=Orosz|prénom1=György|titre=The role of diaryl oxalates in peroxioxalate chemiluminescence|journal=Tetrahedron|date=janvier 1989|volume=45|numéro=11|pages=3493–3506|doi=10.1016/S0040-4020(01)81028-0}}</ref>. Cette dioxétanedione réagit ensuite avec un [[colorant]], se décomposant en [[dioxyde de carbone]] et laissant le colorant dans un [[état excité]]. Lorsqu'il retourne à l'état non-excité, il libère un photon en lumière visible. |
étant responsables de la [[chimiluminescence]].<ref name="Francis Rouessac, Annick Rouessac">{{ouvrage| auteur=Francis Rouessac, Annick Rouessac | titre=Chemical Analysis Modern Instrumentation Methods and Techniques | éditeur=John Wiley & Sons | isbn=978-1-118-68187-9 | année=2013}}</ref>. Par réaction avec le [[peroxyde d'hydrogène]], il se forme la [[1,2-Dioxétanedione|1,2-dioxétanedione]] ainsi que deux molécules de [[phénol (molécule)|phénol]]<ref>{{article|nom1=Orosz|prénom1=György|titre=The role of diaryl oxalates in peroxioxalate chemiluminescence|journal=Tetrahedron|date=janvier 1989|volume=45|numéro=11|pages=3493–3506|doi=10.1016/S0040-4020(01)81028-0}}</ref>. La réaction passe par un [[Radical (chimie)|biradical]] [[oxalate]] [[Paramagnétisme|paramagnétique]]<ref>{{Article|langue=en|prénom1=Richard|nom1=Bos|prénom2=Sarah A|nom2=Tonkin|prénom3=Graeme R|nom3=Hanson|prénom4=Christopher M|nom4=Hindson|prénom5=Kieran F|nom5=Lim|prénom6=Neil W|nom6=Barnett|année = 2009 |titre = In Search of a Chemiluminescence 1,4-Dioxy Biradical |périodique = Journal of the American Chemical Society|lien périodique=Journal of the American Chemical Society|volume = 131|série= 8|pages = 2770–2771|doi = 10.1021/ja808401p}}</ref>. Cette dioxétanedione réagit ensuite avec un [[colorant]], se décomposant en [[dioxyde de carbone]] et laissant le colorant dans un [[état excité]]. Lorsqu'il retourne à l'état non-excité, il libère un photon en lumière visible. |
||
:[[Image:Cyalume-reactions.svg|500px]] |
:[[Image:Cyalume-reactions.svg|500px]] |
||
Version du 19 octobre 2019 à 11:46
| Oxalate de diphényle | ||

| ||
 | ||
| Identification | ||
|---|---|---|
| No CAS | ||
| No ECHA | 100.203.380 | |
| No RTECS | RO2880000 | |
| PubChem | 18475 | |
| InChI | ||
| Propriétés chimiques | ||
| Formule | C14H10O4 [Isomères] |
|
| Masse molaire[1] | 242,226 8 ± 0,013 1 g/mol C 69,42 %, H 4,16 %, O 26,42 %, |
|
| Propriétés physiques | ||
| T° fusion | 136 °C[2] | |
| Précautions | ||
| SGH[3] | ||
| H302, P264, P270, P301+P312+P330 et P501 |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'oxalate de diphényle, aussi appelé commercialement cyalume est un composé organique de la famille des oxalates, de formule (C6H5O2C)2. C'est le diester de phényle de l'acide oxalique.
Propriétés
L'oxalate de diphényle se présente sous la forme d'un solide blanc à jaunâtre, insoluble dans l'eau.
Synthèse
L'oxalate de diphényle est obtenu par transestérification de l'oxalate de diméthyle par le phénol[4].
Utilisations
L'oxalate de diphényle est un important précurseur dans la synthèse du carbonate de diphényle[4]. C'est un des composants utilisé des les bâtons lumineux (« glowsticks »), ces produits d'oxydation étant responsables de la chimiluminescence.[5]. Par réaction avec le peroxyde d'hydrogène, il se forme la 1,2-dioxétanedione ainsi que deux molécules de phénol[6]. La réaction passe par un biradical oxalate paramagnétique[7]. Cette dioxétanedione réagit ensuite avec un colorant, se décomposant en dioxyde de carbone et laissant le colorant dans un état excité. Lorsqu'il retourne à l'état non-excité, il libère un photon en lumière visible.
La vitesse de réaction dépend du pH ; une solution légèrement basique, obtenue en ajoutant une base faible comme le salicylate de sodium, permet une réaction plus rapide, ce qui produit une lumière plus brillante.
Les différents colorants utilisés sont :
| Couleur | Composé | |
|---|---|---|
| Bleu | 9,10-Diphénylanthracène |  |
| Vert | 9,10-Bis(phényléthynyl)anthracène |  |
| Jaune-vert | Tétracène | |
| Jaune | 1-Chloro-9,10-bis(phényléthynyl)anthracène | 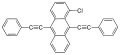 |
| Orange | 5,12-Bis(phenyléthynyl)naphtacène |  |
| Rubrène |  | |
| Rhodamine 6G | 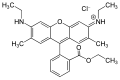 | |
| Rouge | Rhodamine B | 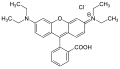 |
L'oxalate de diphényle est parfois remplacé par l'ester du 2,4,6-trichlorophénol de l'acide oxalique, le trichlorophénolate étant un meilleur groupe partant, ce qui accélère la réaction, et produit encore une fois une lumière plus brillante.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Diphenyl oxalate » (voir la liste des auteurs) et en allemand « Oxalsäurediphenylester » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Oxalic Acid Diphenyl Ester sur la base de donnée ChemBlink, consultée le 16 octobre 2019
- TCI America: Diphenyl Oxalate 3155-16-6.
- (de) « Oxalsäureester », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Francis Rouessac, Annick Rouessac, Chemical Analysis Modern Instrumentation Methods and Techniques, John Wiley & Sons, (ISBN 978-1-118-68187-9)
- György Orosz, « The role of diaryl oxalates in peroxioxalate chemiluminescence », Tetrahedron, vol. 45, no 11, , p. 3493–3506 (DOI 10.1016/S0040-4020(01)81028-0)
- (en) Richard Bos, Sarah A Tonkin, Graeme R Hanson, Christopher M Hindson, Kieran F Lim et Neil W Barnett, « In Search of a Chemiluminescence 1,4-Dioxy Biradical », Journal of the American Chemical Society, 8e série, vol. 131, , p. 2770–2771 (DOI 10.1021/ja808401p)


