| Cétane
|

|
 |
| Représentations de l'hexadécane |
| Identification |
| Nom UICPA
|
hexadécane
|
| Synonymes
|
n-hexadécane
|
| No CAS
|
544-76-3
|
| No ECHA
|
100.008.072 |
| No CE
|
208-878-9
|
| PubChem
|
11006
|
| ChEBI
|
45296
|
| SMILES
|
|
| InChI
|
InChI : vue 3D InChI=1S/C16H34/c1-3-5-7-9-11-13-15-16-14-12-10-8-6-4-2/h3-16H2,1-2H3 InChIKey : DCAYPVUWAIABOU-UHFFFAOYSA-N |
| Apparence
|
liquide incolore
|
| Propriétés chimiques |
| Formule
|
C16H34 [Isomères]
|
| Masse molaire[2]
|
226,441 2 ± 0,015 2 g/mol
C 84,87 %, H 15,13 %,
|
| Diamètre moléculaire
|
0,845 nm[1]
|
| Propriétés physiques |
| T° fusion
|
18,1 °C[réf. souhaitée]
|
| T° ébullition
|
286,86 °C[3]
|
| Paramètre de solubilité δ
|
16,3 J1/2·cm-3/2 (25 °C)[1]
|
| Masse volumique
|
équation[4] : 
Masse volumique du liquide en kmol·m-3 et température en kelvins, de 291,31 à 723 K.
Valeurs calculées :
0,76967 g·cm-3 à 25 °C.
| T (K) |
T (°C) |
ρ (kmol·m-3) |
ρ (g·cm-3) |
|---|
| 291,31 |
18,16 |
3,4187 |
0,77415 |
| 320,09 |
46,94 |
3,33466 |
0,75512 |
| 334,48 |
61,33 |
3,29189 |
0,74544 |
| 348,87 |
75,72 |
3,2486 |
0,73563 |
| 363,26 |
90,11 |
3,20473 |
0,7257 |
| 377,65 |
104,5 |
3,16026 |
0,71563 |
| 392,04 |
118,89 |
3,11513 |
0,70541 |
| 406,43 |
133,28 |
3,06931 |
0,69503 |
| 420,82 |
147,67 |
3,02273 |
0,68449 |
| 435,21 |
162,06 |
2,97535 |
0,67376 |
| 449,6 |
176,45 |
2,92708 |
0,66283 |
| 463,99 |
190,84 |
2,87786 |
0,65168 |
| 478,38 |
205,23 |
2,8276 |
0,6403 |
| 492,77 |
219,62 |
2,77619 |
0,62866 |
| 507,16 |
234,01 |
2,72351 |
0,61673 |
|
| T (K) |
T (°C) |
ρ (kmol·m-3) |
ρ (g·cm-3) |
|---|
| 521,54 |
248,39 |
2,66943 |
0,60448 |
| 535,93 |
262,78 |
2,61378 |
0,59188 |
| 550,32 |
277,17 |
2,55635 |
0,57887 |
| 564,71 |
291,56 |
2,49689 |
0,56541 |
| 579,1 |
305,95 |
2,43511 |
0,55142 |
| 593,49 |
320,34 |
2,37061 |
0,53682 |
| 607,88 |
334,73 |
2,30289 |
0,52148 |
| 622,27 |
349,12 |
2,23125 |
0,50526 |
| 636,66 |
363,51 |
2,15476 |
0,48794 |
| 651,05 |
377,9 |
2,07203 |
0,4692 |
| 665,44 |
392,29 |
1,98087 |
0,44856 |
| 679,83 |
406,68 |
1,87754 |
0,42516 |
| 694,22 |
421,07 |
1,75445 |
0,39729 |
| 708,61 |
435,46 |
1,59097 |
0,36027 |
| 723 |
449,85 |
1,060 |
0,24003 |
|

|
| T° d'auto-inflammation
|
201 °C[réf. souhaitée]
|
| Point d’éclair
|
135 °C[réf. souhaitée]
|
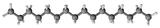
| Pression de vapeur saturante
|
équation[4] : 
Pression en pascals et température en kelvins, de 291,31 à 723 K.
Valeurs calculées :
0,2 Pa à 25 °C.
| T (K) |
T (°C) |
P (Pa) |
|---|
| 291,31 |
18,16 |
0,092 |
| 320,09 |
46,94 |
1,8 |
| 334,48 |
61,33 |
6,27 |
| 348,87 |
75,72 |
19,24 |
| 363,26 |
90,11 |
52,77 |
| 377,65 |
104,5 |
131,34 |
| 392,04 |
118,89 |
300,18 |
| 406,43 |
133,28 |
636,48 |
| 420,82 |
147,67 |
1 263,16 |
| 435,21 |
162,06 |
2 364,29 |
| 449,6 |
176,45 |
4 201,19 |
| 463,99 |
190,84 |
7 127,78 |
| 478,38 |
205,23 |
11 604,26 |
| 492,77 |
219,62 |
18 208,01 |
| 507,16 |
234,01 |
27 641,57 |
|
| T (K) |
T (°C) |
P (Pa) |
|---|
| 521,54 |
248,39 |
40 737,55 |
| 535,93 |
262,78 |
58 461,16 |
| 550,32 |
277,17 |
81 911,06 |
| 564,71 |
291,56 |
112 319,72 |
| 579,1 |
305,95 |
151 054,4 |
| 593,49 |
320,34 |
199 619,85 |
| 607,88 |
334,73 |
259 663,96 |
| 622,27 |
349,12 |
332 987,23 |
| 636,66 |
363,51 |
421 556,92 |
| 651,05 |
377,9 |
527 526,67 |
| 665,44 |
392,29 |
653 262,29 |
| 679,83 |
406,68 |
801 374,32 |
| 694,22 |
421,07 |
974 758,18 |
| 708,61 |
435,46 |
1 176 642,57 |
| 723 |
449,85 |
1 410 600
|
|
 |
| Point critique
|
1 400 kPa[5], 448,85 °C[3]
|
| Thermochimie |
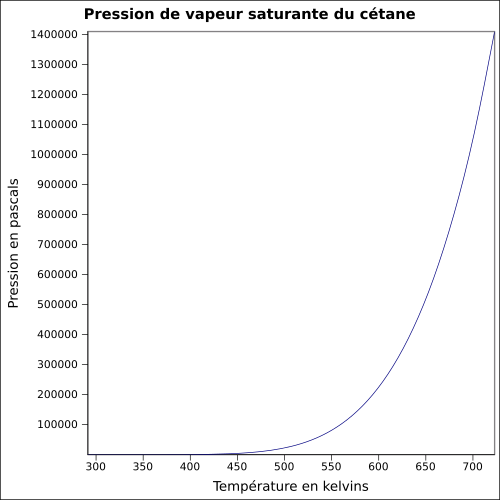
| Cp
|
équation[4] : 
Capacité thermique du liquide en J·kmol-1·K-1 et température en kelvins, de 291,31 à 560,01 K.
Valeurs calculées :
500,372 J·mol-1·K-1 à 25 °C.
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 291,31 |
18,16 |
496 020 |
2 190 |
| 309 |
35,85 |
507 405 |
2 241 |
| 318 |
44,85 |
513 361 |
2 267 |
| 327 |
53,85 |
519 428 |
2 294 |
| 336 |
62,85 |
525 607 |
2 321 |
| 345 |
71,85 |
531 896 |
2 349 |
| 354 |
80,85 |
538 297 |
2 377 |
| 362 |
88,85 |
544 080 |
2 403 |
| 371 |
97,85 |
550 691 |
2 432 |
| 380 |
106,85 |
557 413 |
2 462 |
| 389 |
115,85 |
564 246 |
2 492 |
| 398 |
124,85 |
571 191 |
2 522 |
| 407 |
133,85 |
578 247 |
2 554 |
| 416 |
142,85 |
585 413 |
2 585 |
| 425 |
151,85 |
592 691 |
2 617 |
|
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 434 |
160,85 |
600 080 |
2 650 |
| 443 |
169,85 |
607 581 |
2 683 |
| 452 |
178,85 |
615 192 |
2 717 |
| 461 |
187,85 |
622 915 |
2 751 |
| 470 |
196,85 |
630 749 |
2 785 |
| 479 |
205,85 |
638 694 |
2 821 |
| 488 |
214,85 |
646 750 |
2 856 |
| 497 |
223,85 |
654 918 |
2 892 |
| 506 |
232,85 |
663 196 |
2 929 |
| 515 |
241,85 |
671 586 |
2 966 |
| 524 |
250,85 |
680 087 |
3 003 |
| 533 |
259,85 |
688 699 |
3 041 |
| 542 |
268,85 |
697 423 |
3 080 |
| 551 |
277,85 |
706 257 |
3 119 |
| 560,01 |
286,86 |
715 210 |
3 158 |
|
équation[6] : 
Capacité thermique du gaz en J·mol-1·K-1 et température en kelvins, de 150 à 1 500 K.
Valeurs calculées :
380,916 J·mol-1·K-1 à 25 °C.
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 150 |
−123,15 |
248 600 |
1 098 |
| 240 |
−33,15 |
328 195 |
1 449 |
| 285 |
11,85 |
368 973 |
1 629 |
| 330 |
56,85 |
409 790 |
1 810 |
| 375 |
101,85 |
450 234 |
1 988 |
| 420 |
146,85 |
489 932 |
2 164 |
| 465 |
191,85 |
528 551 |
2 334 |
| 510 |
236,85 |
565 795 |
2 499 |
| 555 |
281,85 |
601 409 |
2 656 |
| 600 |
326,85 |
635 177 |
2 805 |
| 645 |
371,85 |
666 923 |
2 945 |
| 690 |
416,85 |
696 507 |
3 076 |
| 735 |
461,85 |
723 831 |
3 197 |
| 780 |
506,85 |
748 836 |
3 307 |
| 825 |
551,85 |
771 500 |
3 407 |
|
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 870 |
596,85 |
791 843 |
3 497 |
| 915 |
641,85 |
809 923 |
3 577 |
| 960 |
686,85 |
825 835 |
3 647 |
| 1 005 |
731,85 |
839 717 |
3 708 |
| 1 050 |
776,85 |
851 744 |
3 761 |
| 1 095 |
821,85 |
862 130 |
3 807 |
| 1 140 |
866,85 |
871 128 |
3 847 |
| 1 185 |
911,85 |
879 032 |
3 882 |
| 1 230 |
956,85 |
886 173 |
3 913 |
| 1 275 |
1 001,85 |
892 923 |
3 943 |
| 1 320 |
1 046,85 |
899 690 |
3 973 |
| 1 365 |
1 091,85 |
906 926 |
4 005 |
| 1 410 |
1 136,85 |
915 118 |
4 041 |
| 1 455 |
1 181,85 |
924 794 |
4 084 |
| 1 500 |
1 226,85 |
936 521 |
4 136 |
|
|
| Propriétés optiques |
| Indice de réfraction
|
 1,4325[1] 1,4325[1]
|
| Précautions |
| SIMDUT[7] |

D2B, D2B : Matière toxique ayant d'autres effets toxiques
Divulgation à 1,0% selon les critères de classification
|
| NFPA 704 |
|
| Directive 67/548/EEC |
Symboles : Xn : NocifF+ : Extrêmement inflammableN : Dangereux pour l’environnementPhrases R : R24 : Toxique par contact avec la peau. R65 : Nocif : peut provoquer une atteinte des poumons en cas d’ingestion. R66 : L’exposition répétée peut provoquer dessèchement ou gerçures de la peau. Phrases S : S23 : Ne pas respirer les gaz/fumées/vapeurs/aérosols [terme(s) approprié(s) à indiquer par le fabricant]. S62 : En cas d’ingestion, ne pas faire vomir. Consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette.
|
|
| Unités du SI et CNTP, sauf indication contraire. |
modifier  |















