Réaction de Kinugasa
La réaction de Kinugasa est une réaction d'addition d’une nitrone sur un alcyne développée par Manabu Kinugasa et Shizunobu Hashimoto en 1972[1].
Réaction[modifier | modifier le code]
Tout comme la synthèse de Staudinger (en) et la condensation énolate-imine, elle permet de former des 𝛃-Lactames qui sont largement utilisés dans l’industrie médicale[2], notamment dans la production d'antibiotiques comme la pénicilline. La réaction de Kinugasa permet d’avoir des hauts excès énantiomériques, cependant malgré son potentiel, elle est peu utilisée dans l’industrie puisqu’elle génère beaucoup de produits secondaires, notamment des imines et des amides[3]. La réaction a été grandement améliorée au cours des années ; à présent, du cuivre en présence de ligands est utilisé pour catalyser la réaction dans la majorité des cas.
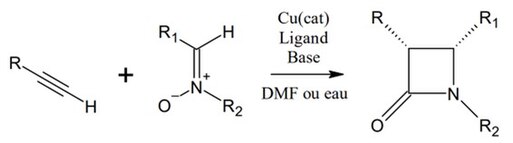
La réaction de Kinugasa nécessite en plus de la nitrone et de l’alcyne, un donneur de cuivre(I), des ligands dont la nature peut influencer la stéréosélectivité de la réaction, et une base, le solvant utilisé est le DMF mais la réaction peut aussi être réalisée dans l’eau. La réaction est à l’origine de beaucoup de produits secondaires.

Synthèse de nitrone[modifier | modifier le code]

Les nitrones sont des composés organiques comportant un groupe fonctionnel azote-oxygène, avec une double liaison entre l’azote et le carbone, un oxygène avec une charge négative et une charge positive sur l’azote. La double liaison carbone-azote est beaucoup plus polarisée que celle des imines rendant ainsi le carbone plus électrophile et la molécule plus réactive que les imines lors des réactions de substitution électrophile aromatique[4]. Les nitrones peuvent être synthétisées par diverses méthodes d’oxydation ou de condensation. L'oxydation peut être réalisée en solution aqueuse avec des oxydants tels que MnO2, NaClO ou en milieu aérobie catalysé par des nanoparticules d’or[4]. En 2024, la réaction la plus pratique est l’oxydation d’une amine secondaire. Cette réaction nécessite un catalyseur et un oxydant, le plus utilisé étant le peroxyde d'hydrogène aqueux car il est bon marché, vert et permet un assez bon rendement (souvent 80%)[4].
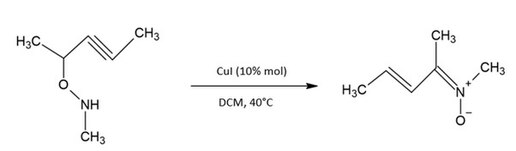
La réaction de condensation peut être effectuée en utilisant une cétone ou un aldéhyde en combinaison avec l'hydroxylamine, ou en utilisant l'hydroxylamine en combinaison avec un alcényle boronique[4]. La nitrone exploitée dans la réaction de Kinugasa est synthétisée avec du cuivre iodé[4] :
Mécanisme[modifier | modifier le code]
À ce jour, il n’y a pas encore de consensus sur le vrai mécanisme de la réaction de Kinugasa. En effet, de nombreux mécanismes ont été proposés dont certains qui font apparaître des intermédiaires cétènes, d’autres qui passent par des cycles à 5 puis des réarrangements et enfin des mécanismes qui font intervenir plusieurs cuivres. Le mécanisme le plus référencé commence avec une addition [3+2] de la nitrone sur les carbones 2 et 3 de l’alcyne. Une fois le cycle formé, celui-ci est détruit, formant un intermédiaire cétène. L’azote s’additionne sur le carbone qui porte la double liaison oxygène pour former le cycle caractéristique des β-lactames. Une fois le cycle formé, il y a départ du cuivre et les électrons de la double liaison forment une liaison avec un proton[5].

Un mécanisme faisant intervenir des calculs utilisant la théorie de la fonctionnelle de la densité (DFT) à été proposé. Dans ce mécanisme, la réaction est catalysée par deux cuivre pour un alcyne et passe par un intermédiaire cyclique à 5 chaînons qui se dissocie en un cétène et une imine. L’imine s’additionne au cétène, puis la molécule se cyclise en un cycle à 4 chaînons par une attaque nucléophile sur le carbone qui porte l’oxygène. Enfin, avec l’intervention d’une base, la 𝛃-Lactames est obtenue[6],[3].

Stéréochimie[modifier | modifier le code]


Le choix du ligand est important pour contrôler la stéréosélectivité de la réaction. Pour les réactions de Kinugasa intramoléculaires, les ligands plan-chiraux de type “phospha-ferrocene oxazoline” permettent une très bonne stéréosélectivité avec des excès énantiomériques pouvant atteindre 91% selon les substituant présents sur les réactifs de départ[7]. Pour des réaction de Kinugasa bimoléculaires, les ligands bis-azaferrocene méthylés permettent aussi une très bonne énantiosélectivité pouvant atteindre 95%[7] . Ces ligands permettent principalement d’obtenir, avec une très bonne énantiosélectivité, les composé cis cinétiquement plus favorable. Pour obtenir le composé trans, il est possible de faire varier d’autres paramètres comme le choix de la base, du solvant ou bien de la température. Par exemple, une manière d’obtenir le composé trans est d’utiliser une base forte et très peu nucléophile afin d’isomériser la molécule en sa forme la plus thermodynamiquement favorable. Des bases comme les amines secondaires peu encombrées permettent de favoriser la rencontre avec le proton à enlever pour pouvoir isomériser la molécule[8],[9].
Applications[modifier | modifier le code]
Antibiotiques[modifier | modifier le code]
Les 𝛃-Lactames jouent un rôle essentiel en médecine et dans l’industrie pharmaceutique. Ces derniers ont un pouvoir non seulement antibactérien mais également anticancérigène et antiviral, et permettent de lutter contre les infections. Ils agissent sur le processus de transpeptidation qui permet de lier les peptidoglycanes de la paroi bactérienne. On les retrouve dans la plupart des antibiotiques tels que la pénicilline, les céphalosporines et beaucoup d’autres.
Cependant, certaines bactéries peuvent développer une résistance à ces antibiotiques. Ceci est dû à la présence d’une famille d’enzymes, les 𝛃-Lactamases. Ces derniers causent l’interruption du processus de transpeptidation en hydrolysant les cycles des 𝛃-Lactames des antibiotiques utilisés et ainsi désactiver les propriétés antibiotiques de la molécule. On peut donner l’exemple des pénicillinases qui présentent une spécificité de substrat pour les pénicillines.

La réaction de Kinugasa respecte certains principes de la chimie verte car son économie atomique est élevée et les matières premières sont accessibles. Il est en réalité facile de trouver des alcynes terminaux avec différents types de substituants commercialement ou de les obtenir à partir de divers précurseurs. De plus, comme vu précédemment, les nitrones sont des composés stables et simples à préparer et à manipuler. Cependant, le problème des produits secondaires ne permet pas à la réaction d’être utilisée à des fins commerciales[9].
Chimie Bio-orthogonale[modifier | modifier le code]
La chimie bio-orthogonale se réfère à des réactions qui se produisent efficacement dans des conditions biologiques, telles que la température ambiante ou proche, en solutions aqueuses, en présence de molécules biologiques. En effet, diverses stratégies de ligation chimique ont été élaborées pour satisfaire les critères de bio-orthogonalité. Celles-ci comprennent la cycloaddition 1,3-dipolaire entre les azides et les cyclooctynes, la réaction entre les nitrones et les cyclooctynes , la formation d’oximes à partir d’aldéhydes et de cétones. Des avancées récentes ont rendu possible l'utilisation de la réaction de Kinugasa en tant que réaction de chimie "click" bio-orthogonale dans les applications de marquage biologique.
En chimie de synthèse, l’efficacité d’une réaction est évaluée en fonction du rendement du produit recherché par l’expérimentateur, c'est-à-dire qu’une réaction est considérée réussie si le rendement est suffisamment élevé. En chimie bio-orthogonale, le rendement n’est pas aussi important puisqu’il suffit qu’il y ait suffisamment de produit marqué pour que le marquage fluorescent soit efficace, ainsi un haut rendement n’est pas nécessaire. Une stéréosélectivité faible voire une formation de produit insatisfaisante du point de vue synthétique ne constituent pas nécessairement des obstacles à une stratégie de marquage biologique réussie. En ce qui concerne le marquage bio-orthogonal, le rendement global de la réaction de Kinugasa peut être assez élevé. Si la liaison C-C nouvellement formée entre l'étiquette métabolique et le marqueur reste intacte, le marquage est considéré comme réussi.

La réaction de Kinugasa a été utilisée pour marquer des protéines in vitro, notamment pour radio-marquer un échantillon de protéines au fluor 18. Avec la demande croissante de biomolécules marquées au fluor-18, la méthode a été améliorée en utilisant une approche CuAAC moins toxique pour marquer spécifiquement une protéine modèle. Le marquage est réalisé en introduisant un des réactifs de Kinugasa sous une forme dérivée qui va lui permettre de se lier à l’objet biologique, cible du marquage. Ensuite le deuxième réactif, modifié avec un marqueur fluorescent, est introduit afin que la réaction de Kinugasa lui permette de se lier à l’objet, rendant le marqueur et l’objet indissociable[10].
Références[modifier | modifier le code]
- (en) Manabu Kinugasa et Shizunobu Hashimoto, « The reactions of copper(I) phenylacetylide with nitrones », Journal of the Chemical Society, Chemical Communications, no 8, , p. 466–467 (ISSN 0022-4936, DOI 10.1039/C39720000466, lire en ligne, consulté le )
- (en) Shuzhe Sun, Linxuan Wang, Jialin Qi et Zhenghu Xu, « Copper(I)-Catalyzed Kinugasa Reactions in an Undergraduate Organic Chemistry Laboratory », Journal of Chemical Education, vol. 100, no 8, , p. 2986–2991 (ISSN 0021-9584 et 1938-1328, DOI 10.1021/acs.jchemed.2c01007, lire en ligne, consulté le )
- (en) Thomas C. Malig, Diana Yu et Jason E. Hein, « A Revised Mechanism for the Kinugasa Reaction », Journal of the American Chemical Society, vol. 140, no 29, , p. 9167–9173 (ISSN 0002-7863 et 1520-5126, DOI 10.1021/jacs.8b04635, lire en ligne, consulté le )
- (en) Shun-Ichi Murahashi et Yasushi Imada, « Synthesis and Transformations of Nitrones for Organic Synthesis », Chemical Reviews, vol. 119, no 7, , p. 4684–4716 (ISSN 0009-2665 et 1520-6890, DOI 10.1021/acs.chemrev.8b00476, lire en ligne, consulté le )
- (en) Ryo Shintani et Gregory C. Fu, « Copper-Catalyzed Enantioselective Conjugate Addition of Diethylzinc to Acyclic Enones in the Presence of Planar-Chiral Phosphaferrocene-Oxazoline Ligands », Organic Letters, vol. 4, no 21, , p. 3699–3702 (ISSN 1523-7060 et 1523-7052, DOI 10.1021/ol026651c, lire en ligne, consulté le )
- (en) Stefano Santoro et Fahmi Himo, « Mechanism of the Kinugasa Reaction Revisited », The Journal of Organic Chemistry, vol. 86, no 15, , p. 10665–10671 (ISSN 0022-3263 et 1520-6904, PMID 34255506, PMCID PMC8389905, DOI 10.1021/acs.joc.1c01351, lire en ligne, consulté le )
- (en) Gregory C. Fu, « Applications of Planar-Chiral Heterocycles as Ligands in Asymmetric Catalysis », Accounts of Chemical Research, vol. 39, no 11, , p. 853–860 (ISSN 0001-4842 et 1520-4898, DOI 10.1021/ar068115g, lire en ligne, consulté le )
- (en) Zhenling Chen, Lili Lin, Min Wang et Xiaohua Liu, « Asymmetric Synthesis of trans ‐β‐Lactams by a Kinugasa Reaction on Water », Chemistry – A European Journal, vol. 19, no 23, , p. 7561–7567 (ISSN 0947-6539 et 1521-3765, DOI 10.1002/chem.201204373, lire en ligne, consulté le )
- Sebastian Stecko, Bartłomiej Furman et Marek Chmielewski, « Kinugasa reaction: an ‘ugly duckling’ of β-lactam chemistry », Tetrahedron, vol. 70, no 43, , p. 7817–7844 (ISSN 0040-4020, DOI 10.1016/j.tet.2014.06.024, lire en ligne, consulté le )
- (en) Mariya Chigrinova, Douglas A. MacKenzie, Allison R. Sherratt et Lawrence L. W. Cheung, « Kinugasa Reactions in Water: From Green Chemistry to Bioorthogonal Labelling », Molecules, vol. 20, no 4, , p. 6959–6969 (ISSN 1420-3049, PMID 25913933, PMCID PMC6272444, DOI 10.3390/molecules20046959, lire en ligne, consulté le )
