Sclérose tubéreuse de Bourneville
| Spécialité | Génétique médicale et neurologie |
|---|
| OMIM | 191100 |
|---|---|
| DiseasesDB | 13433 |
| MedlinePlus | 000787 |
| eMedicine | 1177711 |
| MeSH | D014402 |
| Patient UK | Tuberous-Sclerosis |
La sclérose tubéreuse de Bourneville (ou STB) est une maladie autosomique dominante faisant partie des phacomatoses. Elle se manifeste par le développement de tumeurs bénignes dans de nombreux organes (c'est pour cela qu'elle est dite « multisystémique »). Elle comporte des manifestations cutanées, cardiaques, cérébrales et rénales. La pénétrance est incomplète, le phénotype à la naissance est donc difficilement prévisible.
Historique
[modifier | modifier le code]

Cette maladie est d'abord décrite par Désiré-Magloire Bourneville en 1880 bien que les manifestations dermatologiques furent décrites en 1835 par Pierre Rayer[1].
Autres noms
[modifier | modifier le code]- Syndrome de Bourneville
- EPILOIA (Epilepsy-Low-Intelligence-Adenoma sebaceum)
Cause
[modifier | modifier le code]C'est une maladie génétique autosomique dominante mais qui s'observe également dans des formes sporadiques dans les deux tiers des cas[2].
Deux gènes sont ciblés : TSC1 (Tuberous Sclerosis Complex 1) situé au niveau du locus q34 du chromosome 9 codant la protéine hamartine ; et TSC2 (Tuberous Sclerosis Complex 2) situé au niveau du locus p13.3 du chromosome 16 codant la protéine tubérine. Ces deux gènes sont dits suppresseurs de tumeurs.
Ces mutations sont diverses (plusieurs centaines de types décrits). Les mutations du gène TSC1 sont plus fréquentes dans les formes familiales.
Dans près de 20 % de cas (formes moins sévères), aucune mutation n'est détectée[3]. Il s'agit peut être alors d'une forme mosaïque de la maladie.
L'hamartine et la tubérine sont présentes dans toutes les cellules. Le dimère, formé par ces deux protéines, régule la croissance et la prolifération cellulaire en inhibant le complexe mTOR[4] (voie de signalisation de la protéine kinase B ou PKB). Les mutations à l'origine de cette maladie causent une activation permanente de ce complexe, avec phosphorylation de protéines en aval de mTOR.
Épidémiologie
[modifier | modifier le code]Elle est de 1 cas sur 6,000 naissances[2]. La pénétrance — probabilité d'être malade lorsque l'on est porteur de la mutation — est de l'ordre de 95 %[5], l'expressivité au sein d'une même famille est variable.
Description
[modifier | modifier le code]La maladie se manifeste essentiellement par l'apparition de nombreuses tumeurs bénignes, dès lors appelées « tubers ». L'atteinte cutanée et neurologique est quasi constante. Celle des reins ou de la rétine est fréquente[2].
Manifestations dermatologiques
[modifier | modifier le code]- Taches hypomélaniques ou achromiques sur la peau, visibles dès l'enfance, siégeant sur le tronc et la racine des membres (aspect en feuille de sorbier).
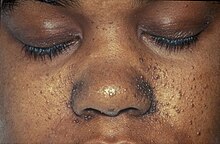
- Angiofibromes — tumeurs bénignes de tissu fibreux avec beaucoup de vaisseaux — de la face, intradermiques, de teinte rougeâtre, prédominant aux ailes du nez. Les UV favoriseraient leur apparition[6].
- Aspect de « peau de chagrin » du bas du dos (aspect d'une plaque en relief, recouverte de « peau d'orange », assez pâle, de contours et de surface irréguliers).
- Tumeur de Koënen des ongles (ou fibromes sous-unguéaux), leur donnant un aspect hyperkératosique par prolifération de collagène et de vaisseaux, apparaissant plutôt chez l'adulte jeune ou l'adolescent.
Manifestations ophtalmologiques
[modifier | modifier le code]- Hamartomes rétiniens
Manifestations neurologiques
[modifier | modifier le code]L'épilepsie précoce (syndrome de West) est la principale manifestation de la maladie, atteignant 60 à 80 % des patients[7], dans deux tiers des cas avant un an[7]. Elle peut être de tout type (focale, généralisée...), se traduisant généralement par des spasmes infantiles avant un an[7]. Les crises sont déclenchées par les masses tubéreuses intracorticales, celles-ci agissent comme des foyers épileptogènes. Ces épilepsies ont une grande résistance aux traitements, mais elles doivent être contrôlées le mieux possible, car elles sont associées à un risque pour l'enfant de développer un syndrome de Lennox-Gastaut[7] (autour de 4-5 ans).
Il peut exister des troubles du comportement et du caractère, de plus, un retard mental est observé chez 40 % des malades[7], et plus rarement une schizophrénie, une hypertension intracrânienne par obstruction des voies par prolifération de cellules géantes épendymaires se voit dans 10 % des cas, des anévrismes cérébraux.
Ces anomalies sont en rapport avec une atteinte du cortex cérébral sous la forme d'« hamartomes tubers », correspondant à une désorganisation de la structure en couches (les circonvolutions sont anormalement grandes et on a perte de l'agencement des neurones), avec prolifération de cellules géantes pouvant se manifester par des tumeurs de type astrocytomes[8] et/ou nodules sous-épendymaires. On les retrouve souvent dans la région du foramen de Monro. Ces tumeurs, bien que bénignes, ont tendance à récidiver si une ablation chirurgicale complète ne peut être effectuée. Une dégénérescence kystique est possible.
Bolton et Griffiths en 1997 décrivent dans The Lancet l'association d'une sclérose tubéreuse des lobes temporaux à une forme atypique d'autisme[9].
Manifestations rénales
[modifier | modifier le code]- Angiomyolipome du rein, fréquents plutôt chez l'adolescent ou l'adulte, se manifestant par des tumeurs multiples et bilatérales. Ce sont des tumeurs souvent très vascularisées, susceptibles de saigner, causant ainsi des hémorragies rétro-péritonéales. Ceci peut entraîner le décès.
- Des kystes épithéliaux, voire une véritable maladie polykystique peut se voir, pouvant évoluer vers l'insuffisance rénale.
- Les cancers rénaux sont rares mais se caractérisent par l'âge précoce de survenue.
Manifestations pulmonaires
[modifier | modifier le code]- Lymphangioléiomyomatose : une prolifération faite de cellules musculaires lisses anormales et formant des kystes peut se voir chez quelques pour cent voire jusque près d'un tiers des jeunes femmes atteintes de sclérose tubéreuse si on les recherche par tomodensitométrie. Elles sont le plus souvent asymptomatiques, mais peuvent se compliquer de pneumothorax, de chylothorax, d'une dyspnée à l'effort voire d'insuffisance respiratoire[10].
- Hyperplasie pneumocytaire multifocale nodulaire : il s'agit d'une autre atteinte pulmonaire, moins fréquente associée à la sclérose tubéreuse, le plus souvent peu symptomatique mais dont l'évolution au long cours est mal connue.
Manifestations cardiaques
[modifier | modifier le code]Les rhabdomyomes cardiaques consistent en des tumeurs d'origine musculaire, à l'intérieur d'une cavité cardiaque. Ils sont très fréquents (près de 60 % des enfants atteints de sclérose tubéreuse), parfois multiples. Ils sont le plus souvent asymptomatiques et sont découverts lors d'une échocardiographie systématique. Ils sont parfois responsables de troubles du rythme cardiaque. Ils peuvent apparaître dès le stade fœtal. L'évolution en est favorable avec une régression spontanée, voire une disparition totale avec l'âge[11].
Diagnostic
[modifier | modifier le code]Les critères diagnostiques ont été revus en 1998[12] :
- sclérose tubéreuse de Bourneville certaine : deux critères majeurs ou un critère majeur et deux critères mineurs
- sclérose tubéreuse de Bourneville probable : un critère majeur et un critère mineur
- sclérose tubéreuse de Bourneville possible : un critère majeur ou deux critères mineurs ou plus
Les critères majeurs sont :
- angiofibrome de la face ;
- rhabdomyome cardiaque unique ou multiple ;
- trois nævi plans ou plus ;
- hamartomes rétiniens ;
- angiomyolipomes rénaux ;
- taches hypomélaniques ou achromiques ;
- fibro-kératomes unguéaux ;
- lymphangioléiomyomatose ;
- lésions tubéreuses corticales multiples ;
- nodules gliaux sous-épendymaires multiples .
Les critères mineurs sont :
- macules hypomélaniques typiques ;
- reins polykystiques bilatéraux ;
- examen radiologique du poumon en nids d’abeille (lymphangiomatose pulmonaire) ;
- angiomyolipome rénal unique ;
- lésions hypomyélinisées sous-corticales multiples ou calcification cortico-sous-corticale en coup d’ongle.
Traitement
[modifier | modifier le code]Il n' y a pas de traitement curatif. Les manifestations neurologiques sont traitées par antiépileptiques. La vigabatrine, un inhibiteur de la GABA transaminase, a une efficacité certaine dans certaines manifestations de type spastique[13].
Les angiomyolipomes rénaux peuvent être traités par embolisation, permettant de traiter ou de prévenir les complications hémorragiques mais avec peu de résultats sur la réduction de la taille des tumeurs[14]. Les angiofibromes de la face peuvent être limités par laser, par une chirurgie ou par une crème à base de rapamycine[15].
Les tumeurs peuvent être enlevées chirurgicalement mais celles situées dans le système nerveux sont parfois d'extraction peu aisée. La récidive est alors la règle.
L'évérolimus, un inhibiteur du système mTOR, permet une réduction en taille des tumeurs rénales[16], hépatiques[17] et cérébrales[18] et de leurs conséquences (épilepsie)[19].
La surveillance des différentes tumeurs est indispensable : scanner crânien pour les lésions cérébrales, échographie pour les tumeurs rénales…
Un conseil génétique doit être proposé en cas de procréation.
Notes et références
[modifier | modifier le code]- (en) Francesco Brigo, Simona Lattanzi, Eugen Trinka et Raffaele Nardone, « First descriptions of tuberous sclerosis by Désiré-Magloire Bourneville (1840–1909) », Neuropathology, vol. 38, no 6, , p. 577–582 (ISSN 1440-1789, DOI 10.1111/neup.12515, lire en ligne, consulté le )
- (en) Curatolo P, Bombardieri R, Jozwiak S, « Tuberous sclerosis » Lancet 2008;372:657-68.
- (en) Sancak O, Nellist M, Goedbloed M et al. « Mutational analysis of the TSC1 and TSC2 genes in a diagnostic setting: genotype–phenotype correlations and comparison of diagnostic DNA techniques in Tuberous Sclerosis Complex » Eur J Hum Genet. 2005;13:731-41.
- (en) Huang J, Manning BD, « The TSC1-TSC2 complex: a molecular switchboard controlling cell growth » Biochem J. 2008;412:179-90.
- (en) Wolkenstein P, « Neurofibromatoses et sclérose tubéreuses de Bourneville » Journal of Neuroradiology 2005;32:174-79.
- « Fiche de vulgarisation : La maladie en question », sur orpha.net, (consulté le )
- http://www.orpha.net/consor/cgi-bin/Disease_Emergency.php?lng=FR&stapage=FICHE_URGENCE_S1 Orphanet, INSERM : Portail des maladies rares et des médicaments orphelins
- (en) Adriaensen MEAPM, Schaefer-Prokop CM, Stijnen T et al. « Prevalence of subependymal giant cell tumors in patients with tuberous sclerosis and a review of the literature » Eur J Neurol. 2009;16:691-6.
- (en) Patrick F. Bolton et Paul D. Griffiths, « Association of tuberous sclerosis of temporal lobes with autism and atypical autism », The Lancet, vol. 349, no 9049, , p. 392–395 (ISSN 0140-6736, e-ISSN 1474-547X, DOI 10.1016/s0140-6736(97)80012-8
 , lire en ligne, consulté le ).
, lire en ligne, consulté le ).
- Urban T, « Lymphangioléiomyomatose pulmonaire avec ou sans sclérose tubéreuse de Bourneville »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), Rev Mal Respir. 2007;24:725-40.
- (en) Smythe JF, Dyck JD, Smallhorn JF, Freedom RM, « Natural history of cardiac rhabdomyoma in infancy and childhood » Am J Cardiol. 1990;66:1247-9.
- (en) Roach ES, Gomez MR, Northrup H, « Tuberous sclerosis complex consensus conference: revised clinical diagnostic criteria » J Child Neurol. 1998;13:624-8
- (en) Hancock E, Osborne JP, « Vigabatrin in the treatment of infantile spasms in tuberous sclerosis: literature review » J Child Neurol. 1999;14:71-4.
- (en) Sooriakumaran P, Gibbs P, Coughlin G et al. « Angiomyolipomata: challenges, solutions, and future prospects based on over 100 cases treated » BJU Int. 2010;105:101-116.
- « Comment soigner la sclérose tubéreuse de Bourneville ? » (consulté le )
- (en) Bissler JJ, Kingswood JC, Radzikowska E et al. « Everolimus for angiomyolipoma associated with tuberous sclerosis complex or sporadic lymphangioleiomyomatosis (EXIST-2): a multicentre, randomised, double-blind, placebo-controlled trial » Lancet 2013;381:817-824.
- (en) Dabora SL, Franz DN, Ashwal S et al. « Multicenter phase 2 trial of sirolimus for tuberous sclerosis: kidney angiomyolipomas and other tumors regress and VEGF-D levels decrease » PLoS One 2011;6:e23379.
- N Desse, J Rakotoarivelo, G Pech-Gourg, A Paz-Paredes, D Scavarda, « Astrocytomes subépendymaires à cellules géantes et sclérose tubéreuse de Bourneville : exérèse ou évérolimus ? » Neurochirurgie 2014;60(6):338-339. DOI 10.1016/j.neuchi.2014.10.048
- (en) Krueger DA, Care MM, Holland K et al. « Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis » N Engl J Med. 2010;363:1801-1811.
Voir aussi
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- La Sclérose tubéreuse de Bourneville sur orphanet
- (fr) Association pour l'Information et la Recherche sur les maladies Rénales Génétiques (AIRG)
- (en) Online Mendelian Inheritance in Man, OMIM (TM). Johns Hopkins University, Baltimore, MD. MIM Number:191900 [1]
- (en) Hope Northrup, Kit-Sing Au, Tuberous Sclerosis Complex in GeneTests: Medical Genetics Information Resource (database online). Copyright, University of Washington, Seattle. 1993-2006[2]

