Réduction des nitriles
Les réductions des nitriles sont un type de réaction organique visant à réduire un groupe nitrile (—C≡N) présent dans un composé organique en un groupe amine (—CH2—NH2) ou aldéhyde (—HC=O) à l'aide de divers réactifs[1],[2].
Hydrogénation catalytique[modifier | modifier le code]
L'hydrogénation catalytique des nitriles est souvent la voie la plus économique pour la synthèse d'amines primaires[3]. Parmi les catalyseurs utilisés, on compte beaucoup de composés des métaux du groupe 10 tels que le nickel de Raney[4],[5],[6], le noir de palladium, ou le dioxyde de platine[1]. Il existe cependant d'autre catalyseurs comme le borure de cobalt (en), qui présentent l'avantage d'être régiosélectifs pour la production d'amines primaires :
- R-C≡N + 2 H2 → R-CH2NH2
Parmi les applications commerciales, on compte la production de l'hexaméthylènediamine à partir de l'adiponitrile, un précurseur du Nylon 66 (en)[7].
Selon les conditions de réaction, les imines, l'intermédiaire réactionnel, peut subir une attaque de l'amine finale pour produire des amines secondaires ou tertiaires :
- 2 R-C≡N + 4 H2 → (R-CH2)2NH + NH3
- 3 R-C≡N + 6 H2 → (R-CH2)3N + 2 NH3
Dans ce cas de figure, une énamine est l'intermédiaire réactionnel[8]. Le plus important facteur permettant de s'assure la production d'amines primaires est le choix du catalyseur[1], viennent ensuite celui du solvant, le pH de la solution, les effets stériques, la température, et la pression en dihydrogène.
Réductions stœchiométriques[modifier | modifier le code]
En amines[modifier | modifier le code]
Parmi les agents réducteurs utilisé pour la réduction non catalytique des nitriles en amines, on compte le tétrahydruroaluminate de lithium, le borohydrure de lithium[9], le diborane[10] et le sodium métallique dans des solvants de type alcool[11].
En aldéhydes[modifier | modifier le code]
Les nitriles peuvent aussi être convertis en aldéhydes par réduction et hydrolyse. La synthèse d'aldéhyde de Stephen utilise le chlorure d'étain(II) et l'acide chlorhydrique pour former un sel d'iminium qui est ensuite hydrolysé en amine. On peut aussi former des aldéhydes avec un donneur d'hydrogène formant un imine qui est ensuite hydrolysé in-situ. On utilise pour ça par exemple de l'acide formique avec un catalyseur pour hydrogénation[12] ou des hydrures métalliques comme le borohydrure de sodium dans un solvant alcoolique avec comme catalyseur CoCl2 ou le nickel de Raney[13].
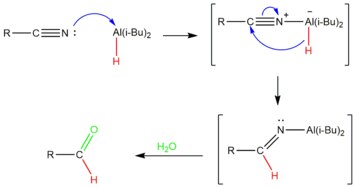
Un hydrure courrament utilisé pour convertir les nitriles en aldéhydes est l'hydrure de diisobutylaluminium ou DIBAL-H[14]. Le mécanisme proposé pour expliquer la réaction implique que le DIBAL forme un adduit acide-base de Lewis avec le nitrile via la formation d'une liaison N-Al ; l'hydrure est ensuite transféré de l'aluminium au nitrile, et le sel d'iminium est ensuite hydrolysé pour obtenir l'aldéhyde désiré[15].
Méthodes électrochimiques[modifier | modifier le code]
Il est possible de réduire les nitriles de benzyle électrochimiquement[16],[17].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nitrile reduction » (voir la liste des auteurs).
- Shigeo Nishimura, Handbook of Heterogeneous Catalytic Hydrogenation for Organic Synthesis, New York, Wiley-Interscience, , 1st éd., 254–277 p. (ISBN 9780471396987, lire en ligne)
- Jerry March (en), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, New York, Wiley, , 3e éd., 1345 p. (ISBN 0-471-85472-7)
- Eller Karsten, Erhard Henkes, Roland Rossbacher et Hartmut Höke, « Amines, Aliphatic », Ullmann's Encyclopedia of Industrial Chemistry, (ISBN 3527306730, DOI 10.1002/14356007.a02_001)
- B. S. Biggs et W. S. Bishop, « Decamethylenediamine », Organic Syntheses, vol. 29, , p. 18 (DOI 10.15227/orgsyn.027.0018)
- C. F. H. Allen et C. V. Wilson, « 2,4-Diphenylpyrrole », Organic Syntheses, vol. 27, , p. 33 (DOI 10.15227/orgsyn.027.0033)
- John C. Robinson et H. R. Snyder, « β-Phenylethylamine », Organic Syntheses, vol. 23, , p. 71 (DOI 10.15227/orgsyn.023.0071)
- Michael Tuttle Musser, « Adipic Acid », Ullmann's Encyclopedia of Industrial Chemistry, (ISBN 3527306730, DOI 10.1002/14356007.a01_269)
- J. Barrault, « Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts », Catalysis Today, vol. 37, no 2, , p. 137–153 (DOI 10.1016/S0920-5861(97)00006-0)
- Atsuhiro Ookawa et Kenso Soai, « Mixed solvents containing methanol as useful reaction media for unique chemoselective reductions within lithium borohydride », The Journal of Organic Chemistry, vol. 51, no 21, , p. 4000–4005 (DOI 10.1021/jo00371a017)
- R. O. Hutchins et B. E. Maryanoff, « 2-tert-Butyl-1,3-diaminoproane », Organic Syntheses, vol. 53, , p. 21 (DOI 10.15227/orgsyn.053.0021)
- C. M. Suter et Eugene W. Moffett, « The Reduction of Aliphatic Cyanides and Oximes with Sodium and n-Butyl Alcohol », Journal of the American Chemical Society, vol. 56, no 2, , p. 487 (DOI 10.1021/ja01317a502)
- T. van Es et B. Staskun, « 4-Formylbenzenesulfonamide », Organic Syntheses, vol. 51, , p. 20 (DOI 10.15227/orgsyn.051.0020)
- Michael Smith et Jerry March, March's advanced organic chemistry : reactions, mechanisms, and structure., New York, Wiley, , 5th éd. (ISBN 9780471585893, OCLC 43936853)
- Carey, F. A.; Sundberg, R. J.; Advanced Organic Chemistry, Part B: Reactions and Synthesis
- Solomons, T W. G, Craig B. Fryhle, and S A. Snyder. Organic Chemistry. , 2014. Print.
- V. Krishnan, A. Muthukumaran et H. V. K. Udupa, « The electroreduction of benzyl cyanide on iron and cobalt cathodes », Journal of Applied Electrochemistry, vol. 9, no 5, , p. 657–659 (DOI 10.1007/BF00610957, S2CID 96102382)
- V. Krishnan, A. Muthukumaran et H. V. K. Udupa, Process for Electrochemical Preparation of beta phenylethylamine using cobalt black cathode, Calcutta, India Patent Office, (lire en ligne)
