Carbonate de manganèse(II)
| Carbonate de manganèse(II) | |

| |
| Précipité frais, d'une couleur éventuellement rose très pâle. | |
| Identification | |
|---|---|
| Nom UICPA | Manganese(II) carbonate |
| No CAS | |
| No ECHA | 100.009.040 |
| No CE | 209-942-9 |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | MnCO3 |
| Masse molaire[1] | 114,946 9 ± 0,001 7 g/mol C 10,45 %, Mn 47,79 %, O 41,76 %, |
| Susceptibilité magnétique | +11 400 × 10−6 cm3/mol[réf. souhaitée] |
| Propriétés physiques | |
| T° fusion | 200 à 300 °C[réf. souhaitée] |
| Solubilité | Négligeable |
| Point d’éclair | Ininflamable |
| Thermochimie | |
| S0solide | 109,5 J mol−1 K−1[2] |
| Cp | 94,8 J mol−1 K−1[2] |
| Cristallographie | |
| Système cristallin | hexagonal-rhomboédrique |
| Propriétés optiques | |
| Indice de réfraction | 1,597 (20 °C, 589 nm)[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le carbonate de manganèse est un composé de formule chimique MnCO3. Il est présent à l'état naturel sous la forme de rhodochrosite minérale, mais il est plus généralement synthétisé par l'industrie chimique et minière. C'est un solide de couleur rose pâle et insoluble dans l'eau. Environ vingt mille tonnes métriques ont été produites en 2005[3].
Structure et fabrication[modifier | modifier le code]
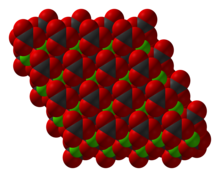
Le MnCO3 adopte une structure semblable à celle de la calcite, constituée d'ions de manganèse(II) dans une géométrie de coordination octaédrique[4].
Sa masse volumique est de 3,12 g/cm3[réf. souhaitée].
Le traitement de solutions aqueuses de nitrate de manganèse(II) avec de l'ammoniac et du CO2 provoque la précipitation de ce solide légèrement rose. Le sous-produit, le nitrate d'ammonium, est utilisé comme engrais.
Réactions et utilisations[modifier | modifier le code]

Le carbonate de manganèse est insoluble dans l'eau mais, comme la plupart des carbonates, s'hydrolyse avec des acides pour donner des sels solubles dans l'eau.
Le carbonate de manganèse se décompose avec dégagement de dioxyde de carbone, c'est-à-dire calcination, à 200 °C pour donner MnO1,88 :
- MnCO3 + 0,44 O2 → MnO1,8 + CO2
Cette méthode est parfois utilisée dans la production de dioxyde de manganèse, un composant des piles sèches et pour les ferrites[3].
Le carbonate de manganèse est surtout utilisé comme additif aux engrais en remédiation de carences en manganèse dans les cultures. Il est également utilisé dans les aliments diététiques, dans la céramique comme colorant et fondant pour glaçure et comme pigment pour le béton teinté.
En médecine, on utilise ses qualités hématiniques, contre l'anémie par exemple.
Toxicité[modifier | modifier le code]
L'empoisonnement au manganèse, connu sous le nom de manganisme, est souvent causé par une exposition prolongée à la poussière ou aux fumées de manganèse.
Voir aussi[modifier | modifier le code]
- Carence en manganèse (santé)
Références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Manganese(II) carbonate ».
- (en) Arno H. Reidies, « Manganese Compounds », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, (ISBN 978-3527306732, DOI 10.1002/14356007.a16_123).
- (en) F. Pertlik, « Structures of hydrothermally synthesized cobalt(II) carbonate and nickel(II) carbonate », Acta Crystallographica Section C, vol. 42, , p. 4–5 (DOI 10.1107/S0108270186097524).
