ATPmétrie
L'ATPmétrie (ou ATP-métrie) est une technique de biologie moléculaire, basée sur le principe de la bioluminescence, qui permet de mesurer quasi instantanément la quantité d'ATP (Adénosine Triphosphate) présente dans un échantillon.
L'ATP est la première source d'énergie de toute cellule vivante. Toute cellule vivante en produit et en consomme. De ce fait, toute trace d'ATP est le témoin d'une trace de vie. Ainsi, quantifier l’ATP présent dans des cellules permet de quantifier les micro-organismes totaux (flore totale ou biomasse totale). La mesure se fait à l’aide d’un luminomètre qui donne le résultat en quelques secondes en Unité Relative de Lumière (URL ou RLU en anglais).
L’ATP-métrie possède de nombreuses applications dans des domaines très variés tels que le contrôle microbiologique des eaux[1], de diverses boissons[2],[3], de surfaces en industrie agroalimentaire (HACCP) ou dans les piscines[4], et même de l’air.
Principe général[modifier | modifier le code]
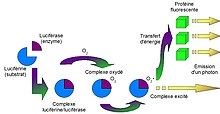
L'ATP-métrie est une technique de mesure basée sur le principe de la bioluminescence. La réaction de bioluminescence est catalysée par une enzyme produite par la luciole : la luciférase. Cette réaction a lieu grâce à l’activation de la luciférine, en présence d’oxygène et de magnésium, par l'hydrolyse d'adénosine triphosphate (ATP). Si les concentrations en luciférine-luciférase et en oxygène sont maintenues constantes, alors l'intensité lumineuse est proportionnelle à la quantité d'ATP. En utilisant la luciférine et la luciférase de la luciole, il est donc possible, grâce à un luminomètre d’avoir une évaluation de la contamination d’un échantillon.
L’ATPmétrie est une mesure de flore totale, c’est-à-dire qu’elle ne permet pas d'identifier les bactéries ou autres espèces spécifiquement. Elle est utilisée comme indicateur pour estimer le risque de contamination d’une eau par des micro-organismes pathogènes comme pour la surveillance du risque Légionelle. Elle permet le suivi d’une installation mais aussi d’établir la cartographie d’un réseau d’eau ou d’air afin d’identifier les points critiques.
ATPmétrie qualitative (1re génération)[modifier | modifier le code]
L’ATPmétrie qualitative existe depuis les années 1980. Cette technique se présente généralement sous la forme d’un « stylo » intégrant un coton-tige ou des ailettes pour le prélèvement, et le réactif de mesure dans la partie haute.
La mesure de bioluminescence ne prend que quelques secondes et se fait à l’aide d’un luminomètre qui donne le résultat en RLU. Or, selon le prélèvement, l’âge de l’enzyme, le luminomètre utilisé ou les conditions d’analyse (pH, température, inhibiteurs ou activateurs) les RLU pour une même quantité d'ATP peuvent varier de façon très importante. Ceci rend les comparaisons difficiles d’un prélèvement à l’autre et impossible d’un type de luminomètre à l’autre. Cette approche est cependant très utilisée pour des analyses « propre vs sale ».
Sur les surfaces[modifier | modifier le code]
L’ATP-métrie qualitative est principalement utilisée pour le contrôle des surfaces en agroalimentaire dans les approches de type HACCP. Le prélèvement de l’échantillon se fait par frottement d’un écouvillon sur la surface à contrôler. L’écouvillon est ensuite mis en contact avec les réactifs pour démarrer la réaction de bioluminescence.
Cette méthode donne un état de propreté de la surface mais ne permet pas de connaitre la quantité de micro-organismes présents. Seule une réponse « positif/négatif » est obtenue.
L’absence de standardisation de la méthode rend son utilisation délicate en milieu industriel avec des résultats peu interprétables[5].
Dans l'eau[modifier | modifier le code]
L’ATP-métrie qualitative est aussi utilisée pour le contrôle des eaux fortement chargées en bactéries. Le prélèvement de l’échantillon se fait par trempage de l’écouvillon dans l’eau à analyser. Seuls approximativement 100 µl d’échantillon sont analysés rendant la fiabilité de la mesure très faible. En effet, l’échantillon prélevé n’est pas représentatif de l’eau analysée et les seuils de sensibilité sont très élevés. Pour remédier à ce problème il est possible de faire plusieurs analyses de la même eau (3 à 5) afin de faire une moyenne des résultats.
De la même façon que pour les surfaces, seule une réponse « positif/négatif » est obtenue car il n’y a pas de calibration de la mesure.
ATPmétrie quantitative (2e génération)[modifier | modifier le code]

Cette évolution de l’ATPmétrie intègre la calibration de la mesure par l’utilisation d’un standard pour passer des RLU au picogramme d’ATP. Il a été établi que lorsque la biomasse totale est considérée, chaque bactérie contient en moyenne 1 femtogramme d’ATP (Wilfred, 1991). Ainsi, il est possible d’estimer la quantité de bactéries présente dans un échantillon en prenant pour convention : 1 pg d’ATP ≈ 1 000 équivalents bactéries.
L’ATPmétrie 2e génération intègre aussi le plus souvent une étape de filtration[réf. souhaitée].
Utilisation d'un étalon[modifier | modifier le code]
Il s’agit de l’addition d’une quantité connue d’ATP. Cet ajout peut être externe ou interne.
En effet, la réaction de bioluminescence étant régie par une enzyme, elle est sensible à l’environnement : température extérieure, température et pH de l’échantillon, présence d’inhibiteurs ou activateurs, état de l’enzyme, etc. mais aussi au type de luminomètre utilisé. De ce fait, l’interprétation des RLU seuls n’est pas pertinente. L’utilisation d’un témoin interne (ajout dosé) ou externe permet la calibration la mesure. L’ajout dosé interne présente l’avantage de prendre en compte toutes les contraintes environnementales agissant sur l’enzyme pour chaque échantillon (température, pH, teneur en sel, inhibiteurs…).
La standardisation permet d’avoir un résultat quantitatif et exploitable sans que la manipulation ne soit ni plus longue et ni plus coûteuse.
La filtration de l'échantillon[modifier | modifier le code]
Suivant les approches, l’étape de filtration peut concentrer quelques millilitres d’échantillon à plus d’un litre. L’utilisation d’une étape de filtration présente de nombreux atouts :
- Large gain en sensibilité de la mesure. Grâce à cette étape, l’ATPmétrie a pu être utilisée pour le contrôle des eaux ultra-pures[6].
- Bonne représentativité de l’échantillon en prélevant un volume plus grand que ce que permet l’ATPmétrie 1re génération.
- Élimination de l’ATP libre. Ainsi, seul l’ATP intracellulaire, contenu dans les cellules intactes, est mesurée.
Après l’étape de filtration, une solution de lyse est utilisée afin de lyser les bactéries et faire sortir l’ATP intracellulaire dans le milieu réactionnel.
Performances[modifier | modifier le code]
Grâce à la filtration et à la standardisation, l’ATPmétrie quantitative est devenue une méthode très robuste, d’autant plus si elle utilise la technique d’ajout dosé interne. Les contraintes de l’environnement n’affectent pas le résultat. Une estimation de la flore totale contenue dans l’échantillon est alors possible.
Cette méthode d’analyse est très sensible et permet d’atteindre des seuils limites de détection, allant jusqu’à 0,1 pgATP par litre soit 100 équivalents bactéries dans 1 litre.
Le majeur atout de cette technique, est qu’elle est facilement utilisable sur le terrain et donne des résultats en temps réel. L’analyse complète peut être effectuée en moins de 2 min.
Applications[modifier | modifier le code]
L’ATPmétrie est utilisée dans de nombreux domaines d’activité[7].
Dans l'eau[modifier | modifier le code]
L’ATPmétrie est un excellent indicateur du niveau de développement de la biomasse et donc du niveau de risque. En effet, la colonisation des surfaces (paroi des conduites d'eau, des systèmes de climatisation) par de la biomasse ou des biofilms est un facteur important du risque de développement des Légionelles[8],[9] et d'autres bactéries comme Pseudomonas aeruginosa et Staphylococcus aureus.
La surveillance de la biomasse active permet donc d’estimer le risque et de le contrôler. Les coûts de charges d’une installation et son impact sur l’environnement sont ainsi réduits par l’optimisation de l’utilisation des biocides.
La rapidité de cette méthode permet un contrôle quotidien afin de réagir rapidement à toute variation de la biomasse dans une installation, contrairement aux méthodes classiques comme la culture cellulaire ou la PCR quantitative[10].
L’ATPmétrie quantitative est aussi un très bon outil de diagnostic des réseaux car elle permet de localiser rapidement un élément défaillant, la présence de bras morts ou des problèmes homogénéisation d’un biocide dans une zone de stockage.
Eaux industrielles[modifier | modifier le code]
L’usage de l’ATPmétrie est largement répandu dans les tours aéroréfrigérantes où le risque légionelle est très présent. Elle est alors couramment utilisée en biosurveillance pour anticiper les dérives et éviter les dépassements réglementaires[11],[12],[13].
Eau chaude sanitaire[modifier | modifier le code]
Les eaux chaudes sanitaires sont également sensibles au développement des légionelles dans les conduites. L’ATPmétrie est utilisée pour prévenir ce risque.
Eau potable[modifier | modifier le code]
Grâce à des limites de détection et quantification de plus en plus basse, l’ATPmétrie est aujourd’hui utilisée pour le contrôle des eaux destinées à la consommation humaine[14]. Elle peut servir aussi bien pour l’analyse de la filière de traitement que pour le contrôle du réseau de distribution d'eau potable. Cet outil d’analyse extrêmement rapide et de terrain permet d’anticiper les dérives et les dépassements réglementaires. Les seuils communément admis sont de 0,1 pg d’ATP par millilitre en sortie de la filière de production, et 0,5 pg d'ATP dans le réseau de distribution[15].
Eau de station d'épuration[modifier | modifier le code]
L’ATPmétrie y est utilisée pour connaître l’état de santé de la biomasse active afin d’optimiser les conditions de fonctionnement de la STEP[16].
Eau de ballaste[modifier | modifier le code]
L’ATPmétrie est utilisée pour prévenir le risque sanitaire[17].
Eau ultra-pure[modifier | modifier le code]
L’ATPmétrie est utilisée pour le contrôle des eaux ultra-pures dans le domaine de la microélectronique ou de la dialyse par exemple[18].
Bain de rinçage[modifier | modifier le code]
L'ATPmétrie est aussi utilisée pour contrôler le développement des bactéries dans les bains de rinçage en galvanoplastie de luxe[19].
Sur les surfaces[modifier | modifier le code]
Le contrôle de la propreté des surfaces passe souvent par une simple inspection visuelle. Cependant, cela n’est pas suffisant pour évaluer correctement l’état microbiologique de la surface. L’ATPmétrie est une méthode permettant d’avoir une idée plus précise.
Elle est largement répandue dans le domaine agroalimentaire, principalement sous la forme qualitative. Cependant, face au peu de fiabilité de cette méthode[5], de plus en plus d’industriels se tournent vers l’ATPmétrie quantitative qui présente l’intérêt de pouvoir caractériser le niveau de saleté. Elle permet le contrôle des surfaces afin de valider les procédés de nettoyage et désinfection mis en place.
Il y a également un intérêt croissant dans le domaine des piscines où l’ATPmétrie est utilisée pour cartographier l’établissement et ainsi identifier les zones propices au développement microbien[4],[20]. Les procédures de nettoyage sont alors adaptées aux résultats obtenus.
Dans l'air[modifier | modifier le code]
Le contrôle de la qualité de l’air est particulièrement poussé en milieu hospitalier où les agents biologiques sont souvent vecteurs de maladies infectieuses. Il l’est également pour le contrôle des salles blanches qui concernent aussi bien l’industrie agroalimentaire ou pharmaceutique, la recherche en biologique que les salles d’opération.
Les contrôles microbiologiques sont de plus en plus demandés. L’ATPmétrie a été utilisée pour quantifier la biomasse totale directement sur le terrain lors d’un projet de recherche[21],[22].
L’ATPmétrie est maintenant réalisable sur des échantillons d’air[23].
Dans les carburants[modifier | modifier le code]
Depuis 2006, l’ATPmétrie est utilisée dans les carburants aériens pour détecter la présence de micro-organismes pouvant mettre en cause la sécurité des vols ou dégrader le matériel. Elle est une méthode de référence pour l’analyse microbiologique des carburants[24].
Dans le sang et les fluides biologiques[modifier | modifier le code]
Si l'ATPmétrie est opérationnelle pour mesurer l'ATP dans l'eau, dans l’air et sur les surfaces, elle a été testée pour une application au sang, en particulier, et à d'autres fluides comme l'urine, afin de détecter précocement les risques d'infections d'origine bactérienne. Cependant, La méthode se heurte aux nombreux inhibiteurs présents dans les liquides biologiques et est donc difficilement applicable[25].
Comparaisons de l'ATPmétrie avec les autres méthodes d'analyse[modifier | modifier le code]
L’ATPmétrie est une mesure de la flore totale vivante. Des études ont comparé cette méthode à des techniques plus traditionnelles comme la culture sur milieu R2A, la qPCR et la cytométrie de flux[26],[15]. Les études ont montré une bonne corrélation de l'ATPmétrie avec les différentes méthodes d'analyses.
Autre approche : les Nucléotides Adényliques[modifier | modifier le code]
La concentration en ATP dans une cellule varie en fonction de son état physiologique, alors que pour une cellule "adulte" vivante, le taux des Nucléotides Adényliques (NA) est constant. Ceci s'explique par l'état physiologique de la biomasse dominante du milieu.Toute cellule vivante, à l'état de vie ralentie (spore par exemple), n'a pratiquement pas d'ATP mais beaucoup d'AMP. Il est donc utile de doser les concentrations en NA (ATP+ADP+AMP) intra et extra cellulaire. Et ceci sans allonger le temps de réponse par rapport au dosage de l'ATP seul. Ainsi, non seulement nous augmentons le seuil de détection (Dans presque tous les cas étudiés à ce jour, on a gagné un facteur de 3 logs et même atteint un facteur de 5 logs).
Cependant, à cause du mélange d'enzymes nécessaires à cette approche, cette analyse est difficile à standardiser et présente donc des problèmes similaires à l'ATPmétrie qualitative. Cette technique a été mise au point par Dominique Champiat en 1984. voir ouvrage "Biochimiluminescence: principes et applications"
Notes et références[modifier | modifier le code]
- Raymond M (2006). L'ATP-métrie: de nombreuses applications dans le domaine du contrôle des eaux. L'Eau, l'industrie, les nuisances, (297), 81-84.
- Ormières, J. F., Lurton, L., & Cao-Thanh, B. (2000). Contrôle microbiologique des vins: utilisation de l'ATP-metrie. In XXVe Congrès Mondial de la Vigne et du Vin: Paris 19-23 juin/June/Junio 2000 (p. 403-408). Office International de la Vigne et du Vin.
- Ormières, J. F., Lurton, L., & Cao-Thanh, B. (2000). Contrôle microbiologique des vins: utilisation de l'ATP-metrie. In XXVe Congrès Mondial de la Vigne et du Vin: Paris 19-23 juin/June/Junio 2000 (p. 403-408). Office International de la Vigne et du Vin.
- Piscine, « Gâches Chimie fête ses 70 ans », sur Activité Piscine, (consulté le )
- « L'ATPmétrie en complément du contrôle microbiologique », sur IFIP, Viandes et produits carnés,
- Dinhill On, « L’ATP-métrie pour maîtriser la qualité d’une eau ultra pure », sur industriepharma.fr, (consulté le )
- « Domaines d'application ATP-métrie | eau industrielle eau sanitaire eau ultra-pure surfaces », sur atp-metrie.fr (consulté le )
- Garrelly L & Raymond M (2007) L'ATP-métrie: un outil de surveillance en temps réel du risque légionelles sur les tours aéroréfrigérantes et réseaux d'eaux. L'Eau, l'industrie, les nuisances, (298), 53-56.
- Magdo, C. (2008). Maîtrise du risque légionelle: Mise en place d'un suivi de la biomasse active par ATP-métrie sur des circuits de refroidissement. TSM. Techniques sciences méthodes, génie urbain génie rural, (résumé).
- Biologie des eaux : méthodes et techniques 1988-1994 Champiat. D, Larpent JP Ed : Masson
- « Management du risque Legionella sur les installations de refroidissement avec tours aéroréfrigérantes humides (TAR) - PDF », sur docplayer.fr (consulté le )
- « L'ATPmétrie fait valoir ses atouts dans l'eau », sur www.environnement-magazine.fr (consulté le )
- C. Magdo, « Maîtrise du risque légionelle - Mise en place d’un suivi de la biomasse active par ATP-métrie sur des circuits de refroidissement », Techniques Sciences Méthodes, no 11, , p. 133–154 (ISSN 0299-7258, DOI 10.1051/tsm/200811133, lire en ligne, consulté le )
- Adélaïde Kasolter, « L’ATP-métrie quantitative, un outil pour l’autocontrôle microbiologique des réseaux d’eau potable », sur Revue EIN, (consulté le )
- Stefano Amalfitano, Caterina Levantesi, Laurent Garrelly et Donatella Giacosa, « Water Quality and Total Microbial Load: A Double-Threshold Identification Procedure Intended for Space Applications », Frontiers in Microbiology, vol. 9, (ISSN 1664-302X, PMID 30574126, PMCID PMCPMC6291452, DOI 10.3389/fmicb.2018.02903, lire en ligne, consulté le )
- « Station de traitement biologique des eaux usées : Optimiser sa performance tout en réduisant les dépenses énergétiques », sur Actu-Environnement (consulté le )
- « Surveillance de la qualité des eaux de ballast par ATP 2G », sur Revue EIN, (consulté le )
- « Qualification de l’ATP-métrie « haute sensibilité » pour le monitoring des eaux ultra-pures »
- « Traitement de surface - Les défauts liés à la présence de micro-organismes en galvanoplastie de luxe », sur gl-biocontrol.com,
- Elsports, « Normes et qualité de l'eau dans les piscines publiques », sur Elsports, (consulté le )
- (en) Bayle S., « Biological and Chemical Atmospheric Emissions of the Biogas Industry », CHEMICAL ENGINEERING TRANSACTIONS, , p. 295-300 (ISSN 2283-9216, lire en ligne)
- Martinez C., « Une nouvelle méthode de terrain pour la détection des bactéries dans l’air », sur gl-biocontrol.com,
- « DENDRIDIAG® AIR - Une analyse en 10 min », sur GL Biocontrol (consulté le )
- « L'analyse des carburants », sur defense.gouv.fr, (consulté le )
- Biochimiluminescence and biomedical applications 1994 D. Champiat & al Cell Biology and Toxicology Volume 10, Numbers 5-6,
- S. Van Nevel, S. Koetzsch, C. R. Proctor et M. D. Besmer, « Flow cytometric bacterial cell counts challenge conventional heterotrophic plate counts for routine microbiological drinking water monitoring », Water Research, vol. 113, 04 15, 2017, p. 191–206 (ISSN 1879-2448, PMID 28214393, DOI 10.1016/j.watres.2017.01.065, lire en ligne, consulté le )
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Brevets[modifier | modifier le code]
- ATP-metry for detecting and counting viruses D. Champiat 2004
- ATP-metry based on intracellular Adenyl Nucleotides for detecting and counting cells, use and implementing method for determining bacteria in particular devoid of ATP. D.Champiat 2004
Bibliographie[modifier | modifier le code]
- De Zutter, L., & Houf, K. ATPmétrie: une méthode rapide pour évaluer l'efficacité du nettoyage et de la désinfection dans l'industrie alimentaire. Résumés du Colloque de Société Française de Microbiologie, Section de Microbiologie des Aliments, Parijs (Frankrijk), 1999, 34.
- Floriot M (2008) Application de l'ATPmétrie à l'épuration par voie biologique. L'Eau, l'industrie, les nuisances, (309), 78-81.
- Garrelly L & Raymond M (2007) L'ATP-métrie: un outil de surveillance en temps réel du risque légionelles sur les tours aéroréfrigérantes et réseaux d'eaux. L'Eau, l'industrie, les nuisances, (298), 53-56.
- Minvielle, B. (2000). Contrôle du nettoyage et de la désinfection: L'ATP-métrie en complément du contrôle microbiologique. Viandes et produits carnés, 21(1), 11-18 (résumé)
- Minvielle, B., & Rugraff, Y. (1999). Intérêt de l'ATP-metrie pour la validation et l'optimisation du nettoyage-desinfection dans le secteur abattage-decoupe. TECHNIPORC, 22, 5-10.
- Oulahal Lagsir, N. (2000). Procédé intégré de quantification de biofilms résiduels des industries agro-alimentaires. Décrochage mixte : ultrasonique- enzymatique et couplage a lATP-métrie (Doctoral dissertation).
- TODOROVA, V., & RAYMOND, M. (2008). BIOLOGIE: Application de l'ATPmétrie à l'épuration par voie biologique. Galvano organo traitements de surface, (778).

